1. Агрегатное состояние дисперсионной фазы и дисперсной среды.
| Дисперсная фаза Диспер- сионная среда | Газ | Жидкость | Твердая |
| Газ | - | Аэрозоли | Дым, пыль |
| Жидкость | Туманы | Эмульсии | Суспензии |
| Твердая | Твердые эмульсии | Гели | Литозоли |
2. Взаимодействие дисперсной фазы и дисперсионной среды (тип классификации используется только для жидких дисперсионных сред). Коллоидные системы делятся на лиофобные и лиофильные.
В лиофобных коллоидных системах дисперсная фаза слабо взаимодействует с дисперсионной средой. Такие системы не могут быть получены самопроизвольно, частицы дисперсной фазы всегда представляют собой агрегаты молекул.
В лиофильных коллоидных системах дисперсная фаза растворима в дисперсионной среде. Ее частицами являются отдельные молекулы больших размеров (макромолекулы).
Оптические свойства коллоидных систем. При прохождении света через коллоидные растворы наблюдается конус Тиндаля (дифракция света на коллоидных частицах). Так как дифракция коротковолнового излучения происходит в большей степени, чем дифракция длинноволнового излучения, то бесцветные коллоидные растворы в отраженном свете имеют голубой цвет, а в проходящем – красный.
Строение коллоидной мицеллы и электрические свойства коллоидных систем. Коллоидные частицы имеют малые размеры и могут существовать во взвешенном состоянии неограниченное время. Это определяет кинетическую устойчивость коллоидных систем. С другой стороны, большая поверхность раздела коллоидной частицы определяет избыточное поверхностное натяжение и тенденцию к «слипанию» коллоидных частиц, которая уменьшает энергетическую нестабильность коллоидных систем.
Стабилизация коллоидных систем происходит за счет адсорбции молекул дисперсионной среды или ионов электролита, находящегося в растворе. На границе коллоидной частицы формируется двойной электрический слой, коллоидные частицы приобретают одинаковый заряд, что препятствует их «слипанию».
Ионы, которые формируют заряд коллоидной частицы, называются потенциалобразующими ионами.
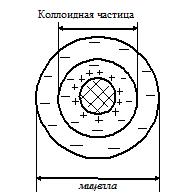
| К ним притягиваются ионы с противоположным зарядом – противоионы, которые располагаются в адсорбционном и диффузионном слоях мицеллы. Между адсорбционным и диффузионным слоями происходит ионный обмен. Коллоидная частица заряжена, а мицелла электронейтральна. |
Пример. Строение мицеллы коллоидной частицы иодида серебра.
Реакция образования иодида серебра может быть представлена в виде:
KI (избыток) + AgNO3  AgI
AgI 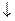 + KNO3
+ KNO3
Строение мицеллы: {m[AgI] nI 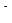 (n-x)K+}
(n-x)K+} 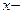 xK+
xK+
где “m” – число молекул иодида серебра в ядре; “n” – число анионов в первом адсорбционном слое коллоидной частицы; n + x = m; обычно m >> n.
Если в избытке находится нитрат серебра, то на поверхности ядра коллоидной частицы в первую очередь группируются ионы серебра, достраивая кристаллическую решетку твердой фазы, а в качестве противоионов выступают нитрат-анионы.
На поверхности ядра мицеллы возникает электрический межфазный потенциал (j- потенциал), который уменьшается при увеличении расстояния от поверхности ядра за счет адсорбции противоионов.
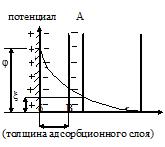
| Если поместить коллоидную частицу в электрическое поле, то противоионы диффузного слоя отрываются от коллоидной частицы и перемещаются в сторону соответствующего электрода, а коллоидная частица – в противоположную сторону. В ее составе остается часть диффузионного слоя (линия АВ показывает границу поверхности скольжения). |
Эффект перемещения коллоидных частиц под действием внешнего электрического поля называется электрофорезом.
Потенциал коллоидной частицы на поверхности скольжения называется электрокинетическим потенциалом или x(зета)-потенциалом.
x-потенциал является мерой устойчивости коллоидных систем: если ½x½< 30 mV, происходит коагуляция (разрушение) коллоидных частиц.
Введение индифферентных сильных электролитов в коллоидные растворы приводит к уменьшению величины x-потенциала в связи с увеличением концентрации противоионов и сжатием диффузного слоя. В том случае, когда концентрация индиферентного электролита достаточно велика, возможно достижение изоэлектрического состояния (x=0).
При введении сильного электролита, содержащего одноименные ионы, происходит дополнительная адсорбция потенциалобразующих ионов на поверхности коллоидной частицы, что приводит к увеличению x-потенциала. После достижения максимально возможной адсорбции электролит, содержащий одноименные ионы, начинает действовать так же, как и индиферентный электролит, то есть x-потенциал уменьшается и после достижения критической величины наступает коагуляция коллоидных частиц.
Коагулирующая способность электролитов характеризуется величиной порога коагуляции – минимальной концентрацией электролита, которая вызывает коагуляцию коллоидного раствора. Порог коагуляции уменьшается с увеличением заряда коагулирующего иона (иона, знак заряда которого аналогичен знаку заряда противоиона коллоидных частиц). Для моно-, ди- и трехзарядных ионов отношение их порогов коагуляции составляет 1:11:72.
В некоторых случаях процесс коагуляции является обратимым. Процесс обратной трансформации коагулята в коллоидный раствор называется пептизация или дезагрегация.
Устойчивость лиофобных золей увеличивается при добавлении небольших количеств растворов высокомолекулярных соединений (например, растворов желатины, таннина и др.). Защитное действие растворов высокомолекулярных соединений связано с образованием адсорбированного защитного слоя на поверхности коллоидной частицы. Характеристикой защитного действия является защитное число – минимальное количество (мг) твердого вещества, которое предотвращает коагуляцию 10 мл коллоидного раствора при добавлении сильного электролита в количестве, определяемом порогом коагуляции.
Условиями образования коллоидных растворов являются нерастворимость дисперсной фазы в дисперсионной среде и присутствие стабилизатора.
Цель работы. Изучение методов получения коллоидных растворов.
Порядок работы
Опыт 1. Приготовление коллоидных растворов. Метод ионного обмена (демонстрационный опыт)
Смешайте в конических колбах или стаканчиках при постоянном перемешивании: (a) 10 мл 0.05 M раствора KI и 8 мл 0.05 M раствора AgNO3; (b) 10 мл раствора AgNO3 и 8 мл раствора KI. Сравните цвет растворов в проходящем и отраженном свете. Перенесите растворы в U-образные трубки и пропустите через них постоянный электрический ток. Наблюдайте явление электрофореза. Отметьте, к какому электроду перемещаются коллоидные частицы в каждом случае, определите знак заряда коллоидной частицы. Запишите уравнение реакции получения коллоидного раствора и схему строения мицеллы.
Опыт 2. Приготовление коллоидных растворов. Метод пептизации
Налейте в стаканчик 1,5 мл 20%-ного раствора K4[Fe(CN)6] и добавьте 0,5 мл насыщенного раствора FeCl3. Отфильтруйте темно-синий осадок KFe[Fe(CN)6] и промойте его сначала дистиллированной водой, а затем 0,1 М раствором H2C2O4. Наблюдайте пептизацию осадка и образование коллоидного раствора (ионы C2O4  адсорбируются на поверхности ядра коллоидной частицы, а ионы водорода выступают в качестве противоионов). Сравните цвет растворов в проходящем и отраженном свете. Запишите уравнение реакции получения коллоидного раствора и схему строения мицеллы.
адсорбируются на поверхности ядра коллоидной частицы, а ионы водорода выступают в качестве противоионов). Сравните цвет растворов в проходящем и отраженном свете. Запишите уравнение реакции получения коллоидного раствора и схему строения мицеллы.
Типовые задачи.
1. После неполного титрования раствора KBr раствором AgNO3 образуется коллоидный раствор. Запишите уравнение реакции получения коллоидного раствора и схему строения мицеллы.
2. После неполного титрования раствора AgNO3 раствором KBr образуется коллоидный раствор. Запишите уравнение реакции получения коллоидного раствора и схему строения мицеллы.
3. Запишите уравнение реакции гидролиза FeCl3 и схему строения мицеллы коллоидной частицы.
4. Запишите уравнение реакции взаимодействия избытка K4[Fe(CN)6] с FeCl3 и схему строения мицеллы.
5. Покажите строение мицеллы коллоидной частицы, образованной при растворении осадка KFe[Fe(CN)6] в 0,1 М растворе H2C2O4 (метод пептизации).
6. Раствор CuSO4 добавили к золю серы, имеющему положительно заряженные коллоидные частицы. Какие ионы будут вызывать коагуляцию?
7. Растворы KCl, K2SO4, K3PO4 и MgSO4 поочередно добавили к золю золота с положительно заряженными коллоидными частицами. Какой электролит имеет минимальный порог коагуляции?
Лабораторная работа 8
Комплексные соединения
Теоретические основы. Комплексными соединениями называются соединения, которые образованы из отдельных, способных к самостоятельному существованию сравнительно простых химических частиц (катионов, анионов, молекул). Примерами комплексных соединений могут служить Na3[Co(NO2)6]; [Cu(NH3)4]SO4; K4[Fe(CN)6].
Один из атомов комплексного соединения, обычно положительно заряженный катион металла, занимает центральное место в комплексе (центральный ион или ион-комплексообразователь). Нейтральные молекулы или ионы с противоположным зарядом (лиганды) образуют с центральным ионом химические связи по донорно-акцепторному механизму. Центральный ион и лиганды образуют внутреннюю сферу комплексного соединения (комплексный ион). Противоположно заряженные ионы, электростатически связанные с комплексным ионом и нейтрализующие его заряд, носят название внешней сферы комплекса.
Общее число химических связей, которые образует с лигандами ион-комплексообразователь, называется координационным числом центрального иона. Число химических связей, образованных одним лигандом с центральным атомом, называется дентатностью лиганда. Выделяют моно-, би- и полидентатные лиганды.
Большинство комплексных соединений являются электролитами. В растворах они необратимо диссоциируют на внутреннюю и внешнюю сферу (первичная диссоциация):
[Cu(NH3)4]SO4 
 [Cu(NH3)4]2+ + SO42
[Cu(NH3)4]2+ + SO42 
Комплексный ион способен к вторичной диссоциации и является слабым электролитом (обратимая и ступенчатая диссоциация):
[Cu(NH3)4]2+  [Cu(NH3)3]2+ + NH3
[Cu(NH3)3]2+ + NH3
[Cu(NH3)3]2+ 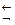 [Cu(NH3)2]2+ + NH3
[Cu(NH3)2]2+ + NH3
[Cu(NH3)2]2+  [Cu(NH3)]2+ + NH3 [Cu(NH3)]2+
[Cu(NH3)]2+ + NH3 [Cu(NH3)]2+ 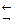 Cu2+ + NH3
Cu2+ + NH3
Суммарный процесс:
[Cu(NH3)4]2+ 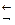 Cu2+ + 4NH3
Cu2+ + 4NH3
Каждый из этих обратимых процессов характеризуется константой равновесия, которая носит название константа нестойкости комплексного иона (ступенчатая или общая). Чем меньше величина константы нестойкости, тем более устойчиво комплексное соединение.
Смещение равновесие реакции диссоциации комплексного иона подчиняется всем описанным ранее правилам смещения химического равновесия: равновесие смещается в сторону более полного связывания молекул и ионов в растворе в молекулы или ионы слабых электролитов (равновесие химической реакции смещается в сторону образования более устойчивого комплексного соединения).
В соответствии с характером диссоциации комплексных соединений выделяют анионные, катионные или нейтральные комплексы.
В катионных комплексах внутренняя сфера имеет положительный заряд (комплексный катион). Лигандами в этом случае обычно являются нейтральные молекулы: [Cr(H2O)6]Cl3, [Co(NH3)6]Cl3.
В анионных комплексах комплексный ион заряжен отрицательно, в качестве лигандов выступают анионы: K2[HgI4], Na[Sb(OH)6].
Лигандами в нейтральных комплексах являются как анионы, так и нейтральные молекулы: [Pt(NH3)2Cl2]. Внешняя сфера отсутствует и первичная диссоциация не происходит.
Цель работы. Изучение свойств комплексных соединений и их реакций в растворах.
Порядок работы.
Опыт 1. Образование комплексных соединений.
Налейте в отдельные пробирки по 5-6 капель солей меди (II), никеля (II) и цинка. По каплям добавляйте раствор NH4OH. Запишите цвета образующихся осадков. Добавьте в пробирки избыток гидроксида аммония и наблюдайте процессы образования комплексных аммиакатов. Оставьте пробирки для следующего опыта. Запишите уравнения реакций образования комплексных соединений. Выпишите значения их констант нестойкости и сравните устойчивость комплексных соединений.
Опыт 2. Разрушение комплексных соединений под действием сильных электролитов.
По каплям добавьте к растворам комплексных аммиакатов, полученных в опыте 1, разбавленную азотную кислоту и наблюдайте процессы разрушения комплексов. Запишите уравнения реакций.
Опыт 3. Образование и свойства комплексных соединений Cd2+ и Hg2+.
Налейте в отдельные пробирки по 5-6 капель солей Cd2+ и Hg2+. По каплям добавляйте насыщенный раствор Na2SO3. Наблюдайте образование осадков сульфитов металлов и их дальнейшее растворение с образованием комплексных соединений типа Na2[M(SO3)2], M= Cd2+ или Hg2+.
Добавьте к растворам комплексных соединений раствор NaOH. Выпадают ли осадки гидроксидов кадмия и ртути? Сравните константы нестойкости комплексных ионов и сделайте вывод.
Опыт 4. Диссоциация комплексных соединений и двойных солей.
а). Налейте в три отдельные пробирки по 5-6 капель двойной соли NH4Fe(SO4)2.
В первую пробирку добавьте 3-4 капли концентрированного раствора гидроксида натрия NaOH, нагрейте пробирку и понюхайте выделяющиеся пары. Запишите наблюдения.
Во вторую пробирку добавьте 2-3 капли раствора BaCl2 , а в третью – раствора KSCN. Запишите наблюдения и сделайте вывод о диссоциации двойной соли. Запишите все уравнения химических реакций.
б). Налейте в две отдельные пробирки по 3-5 капель раствора K3[Fe(CN)6] и добавьте в них соответственно по 2-3 капли Na3[Co(NO2)6] и KSCN. Запишите наблюдения. Сделайте вывод о характере диссоциации комплексного соединения. (Примечание: в присутствии ионов K+ образуется желтый осадок K2Na[Co(NO2)6] ).
Типовые задачи.
1. Для следующих комплексных соединений укажите: (a) состав внутренней и внешней сферы; (б) ион-комплексообразователь, его заряд и координационное число; (в) лиганды и их дентатность; (г) запишите уравнения реакций первичной и вторичной диссоциации и выражение константы нестойкости комплексного иона; (д) назовите комплексные соединения: [Cd(NH3)4]Cl2; K2[Cd(CN)4]
2. Какое из приведенных выше комплексных соединений наиболее устойчиво?
3. Определите тип гибридизации атомных орбиталей и пространственное строение комплексного иона [Ag(NH3)2]+.
4. Вычислить концентрацию ионов кадмия в 0,1 м растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л KCN.
5. Рассчитайте концентрацию ионов серебра в 0,1 M растворе комплексного соединения хлорида диамминсеребра (а) в чистой воде; (б) в присутствии избытка аммиака с концентрацией 1 моль/л.
6. В каком случае возможна реакция обмена лигандов во внутренней сфере комплексных соединений? Запишите уравнения реакций в молекулярном и ионном видах и рассчитайте константу равновесия реакций:
a) K2[HgI4] + KCN =
б)K[Ag(CN)2] + NH3 =
Лабораторная работа 9
Дата: 2019-02-02, просмотров: 362.