Теоретические вопросы
1. Алканы. Основные реакции алканов: галогенирование, нитрование (по Коновалову), сульфохлорирование.
2. Механизм радикального замещения. Стабилизация радикалов. Избирательность реакции галогенирования алканов.
3. Алкены. Гомологический ряд, номенклатура, виды изомерии.
4. Химические свойства алкенов: реакции присоединения галогенов (хлорирование, бромирование), водорода, галогеноводородов, воды.
5. Механизм электрофильного присоединения. Правило Марковников. Эффект Хараша.
6. Окисление двойной связи перманганатом калия в нейтральной и кислой среде. Озонирование алкенов.
7. Полимеризация алкенов, получение полиэтилена, полипропилена, поливинилхлорида.
8. Диеновые углеводороды. Сопряженные 1,3-диены. Особенности реакции присоединения.
9. Полимеризация диеновых углеводородов. Каучуки (природный, синтетические), резина.
10. Изопрен. Природные полимерные производные изопрена – изопреноиды (терпены).
11. Особенности строения и свойств алкинов.
12. Химические свойства алкинов – реакции присоединения водорода, галогенов, галогеноводородов, воды (реакция Кучерова), спиртов, карбоновых кислот, HCN.
13. Получение бензола из ацетилена.
14. Образование ацетиленидов.
15. Галогенпроизводные углеводородов. Изомерия и номенклатура.
16. Гидролиз галогеноалканов. Реакции нуклеофильного замещения SN1 и SN2.
17. Ароматические углеводороды. Номенклатура, изомерия. Бензол, толуол, крезолы, нафталин, антрацен, фенантрен.
18. Электронное строение молекулы бензола. Понятие ароматичности.
19. Реакции присоединения по кратным связям бензольного кольца.
20. Реакции электрофильного замещения бензола: галогенирование, нитрование, алкилирование, ацилирование.
21. Влияние заместителей 1-го рода на реакции замещения в бензольном кольце.
22. Влияние заместителей 2-го рода на реакции замещения в бензольном кольце.
23. Условия введения галогена в бензольное кольцо и в боковую цепь. Сравнение подвижности галогенов разных типов.
24. Устойчивость бензола к действию окислителей. Окисление гомологов бензола.
Экспериментальная часть
Цель работы – изучение химических свойств предельных и непредельных углеводородов.
Внимание! Опыты выполняются в вытяжном шкафу!
Опыт 1 . Получение метана и изучение его свойств.
а) Получение метана. Смесь безводного ацетата натрия и натронной извести в соотношении 6:10 тщательно перемешайте и поместите в пробирку, горизонтально закрепленную в лапке штатива. Пробирку закройте пробкой с газоотводной трубкой. Метан получают нагреванием реакционной смеси в пробирке по реакции:

б) Химические свойства метана. Для изучения химических свойств метана налейте в две пробирки по 0,5 мл 2%-м раствора перманганата калия и бромной воды. Пробирку с газоотводной трубкой, в которой помещен метан, осторожно нагрейте, постепенно усиливая нагревание. Конец газоотводной трубки опустите на 1-2 минуты в раствор перманганата калия, затем на такое же время - в бромную воду. В лабораторном журнале отметьте, изменилась ли окраска растворов в пробирках. Сделайте вывод о взаимодействии метана с водными растворами окислителя и галогена.
в) Горение метана. Не прекращая нагревание реакционной смеси, подожгите метан у конца газоотводной трубки, затем прекратите нагревание пробирки. Запишите уравнение реакции и отметьте цвет пламени горящего метана.
Опыт 2.Получение этилена и изучение его свойств.
а) Получение этилена. В сухую пробирку поместите 1 мл этанола, 3 мл концентрированной серной кислоты и несколько фарфоровых кипелок, необходимых для равномерного кипения при нагревании. Пробирку закройте пробкой с газоотводной трубкой и, чтобы жидкость не вылилась, закрепите на штативе под углом к поверхности стола. Этилен получают нагреванием реакционной смеси по реакции:

б) Химические свойства этилена. Для изучения химических свойств этилена так же, как в опыте 1б, приготовьте две пробирки с растворами перманганата калия и бромной воды по 0,5 мл. Пробирку с газом осторожно нагрейте, конец газоотводной трубки опустите на 1-2 минуты в раствор перманганата калия, затем на такое же время - в бромную воду. Напишите уравнения реакций, отметьте, изменилась ли окраска растворов. Сделайте вывод о взаимодействии этилена с водными растворами окислителя и галогена.
Опыт 3. Взаимодействие бензола и толуола с перманганатом калия.
а) Окисление бензола. Налейте в пробирку с 1 мл бензола и добавьте туда 1 мл водного раствора перманганата калия. Смесь энергично встряхивайте 20-30 секунд. Отметьте в лабораторном журнале, происходит ли обесцвечивание раствора? Сделайте вывод, объяснив причину.
б) Окисление толуола. Смешайте в пробирке 0,5 мл толуола, 2 мл водного раствора перманганата калия и 2 мл 10%-ного раствора серной кислоты. Смесь необходимо встряхивать до обесцвечивания перманганата калия. Запишите наблюдения и реакцию окисления толуола до бензойной кислоты. В выводе объясните, почему, в отличие от предыдущего опыта, окисление происходит.
Типовые задачи
- С помощью какой реакции можно отличить пропен от пропина?
- Как из метана получить бензол? Составьте уравнения всех реакций и укажите условия их протекания.
- Какие углеводороды можно получить при действии металлического натрия на смесь хлорэтана и 2-хлорпропана?
- Напишите реакцию полимеризации 2-метилбутадиена-1,3.
- Осуществите следующие превращения:
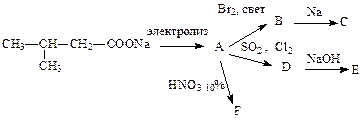
- При пропускании смеси этилена с метаном через склянку с бромной водой, масса склянки увеличилась на 8 г. Сколько литров и какого газа поглощено бромной водой?
- Определить молекулярную формулу углеводорода, если при полном сгорании 0,1 моля этого вещества образовалось 13,44 л оксида углерода (IV).
- Какое бромпроизводное будет предпочтительно получаться при бромировании этилбензола в присутствии металлического железа?
- С помощью какой реакции можно отличить бензол от циклогексена?
- Во сколько стадий можно получить нитробензол из карбида кальция? Составьте уравнения всех реакций и укажите условия их протекания.
- Сколько литров ацетилена необходимо взять для получения 100 г. бензола, если выход продукта составляет 60% от теоретического?
- Какой объем воздуха потребуется для полного сгорания 46 г. толуола (считать, что в воздухе содержится 20% кислорода).
- Осуществите следующие превращения:
1)

2)
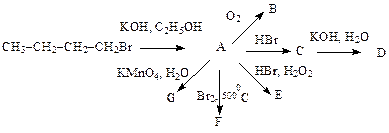
Лабораторная работа 11
Спирты. Фенолы
Теоретические вопросы
1. Одноатомные спирты. Номенклатура, изомерия. Первичные, вторичные и третичные спирты.
2. Особенности строения гидроксильной группы. Физические свойства спиртов. Водородная связь.
3. Способы получения одноатомных спиртов.
4. Химические свойства одноатомных спиртов: взаимодействие с натрием, замена гидроксильной группы на галоген, внутри- и межмолекулярная дегидратация.
5. Простые эфиры: получение, гидролиз.
6. Особенности реакций окисления первичных, вторичных и третичных спиртов.
7. Многоатомные спирты: этиленгликоль, глицерин.
8. Способы получения многоатомных спиртов.
9. Взаимодействие многоатомных спиртов с натрием и гидроксидом натрия.
10. Получение 1,4-диоксана из этиленгликоля.
11. Качественная реакция на многоатомные спирты.
12. Фенолы: строение, методы получения, физические свойства.
13. Химические свойства фенола.
14. Активность фенола в реакциях электрофильного замещения (конденсация фенола с формальдегидом).
15. Многоатомные фенолы: гидрохинон, резорцин, пирокатехин, пирогаллол.
16. Ароматические спирты.
17. Понятие о тиоаналогах спиртов и простых эфиров: меркаптаны, диалкилсульфиды.
Экспериментальная часть
Цель работы – изучение химических свойств одно- и многоатомных спиртов и фенолов.
Опыт 1. Растворимость спиртов в воде.
Возьмите три пробирки и налейте в них по 5 мл дистиллированной воды. В первую добавьте 1 мл этилового спирта, во вторую – 1мл бутилового спирта, в третью – 1 мл амилового спирта. Хорошо встряхните каждую пробирку. Запишите наблюдения и сделайте вывод о растворимости спиртов в зависимости от места в гомологическом ряду. Разделите каждый водно-спиртовый раствор на две пробирки и добавьте в одну из них по 2-3 капли фенолфталеина, а в другую – 2-3 капли метилоранжа. Наблюдается ли изменение окраски индикаторов? Сделайте вывод о кислотно-основных свойствах спиртов.
Опыт 2. Окисление спиртов.
а) Горение спиртов (выполняется в вытяжном шкафу!). В 3 фарфоровые чашки налейте по 1 мл этилового, бутилового и амилового спиртов. Поочерёдно подожгите содержимое. Проследите за характером пламени во всех трёх чашках. Уравнения реакций и наблюдения запишите в лабораторный журнал.
б) Окисление этанола. В сухой пробирке смешайте 2 капли этанола, 2 капли раствора бихромата калия и 1 каплю 10%-ного раствора серной кислоты. Реакционную смесь слегка нагрейте над пламенем горелки до начала изменения цвета. Через несколько секунд появляется зелёная окраска, характерная для солей хрома (III). Остывшую пробирку осторожно понюхайте: образовавшийся ацетальдегид обладает характерным запахом (зеленых яблок). Наблюдения и уравнение реакции запишите в лабораторный журнал.
Опыт 3. Получение хелатных комплексов многоатомных спиртов (гликолятов).
Приготовьте свежий раствор гидроксида меди (II). Для этого в пробирке смешайте 5 капель 2%-ного раствора сульфата меди (II) и 5 капель 10%-ного раствора гидроксида натрия. Отлейте половину получившегося раствора с осадком гидроксида меди (II) во вторую пробирку. В первую пробирку добавьте 1 каплю этиленгликоля и встряхните. Во вторую – 1 каплю глицерина, и тоже встряхните. Происходит ли растворение осадка? Какой цвет у полученного раствора? Наблюдения запишите в лабораторный журнал. Составьте схемы реакций, сделайте вывод о том, какой структурный фрагмент должен содержаться в молекулах спиртов, взаимодействующих с гидроксидом меди (II). Можно ли считать эту реакцию качественной реакцией на много атомные спирты.
Опыт 4. Получение фенолята натрия
В пробирку с 2 мл дистиллированной воды положите 1г фенола и встряхните, оставьте пробирку на некоторое время в штативе. К смеси прибавьте по каплям 10%-ный раствор гидроксида натрия до полного растворения фенола. Запишите в лабораторном журнале уравнение реакции образования фенолята натрия, отметьте изменения в окраске раствора. Содержимое пробирки разделите на две части и добавьте к одной из них раствор 2Н серной кислоты, а к другой – 2Н соляной до помутнения раствора. Вследствие ограниченной растворимости в воде выделившийся фенол образует эмульсию. Запишите наблюдения и уравнения реакций. В выводе сравните кислотность водорода гидроксильных групп спиртов из опыта 3 и фенола. Почему фенол в отличие от алкоголей взаимодействует со щёлочью?
Опыт 5. Бромирование фенола.
Налейте в пробирку 1 мл 3%-ного водного раствора фенола и добавьте к нему 1 мл бромной воды. Содержимое пробирки встряхните. Отметьте появление белых хлопьев трибромфенола. Запишите уравнение реакции, укажите её механизм. В выводе объясните, почему бромирование фенола, в отличие от бромирования бензола, происходит без катализатора.
Типовые задачи
- Напишите все возможные изомеры соединения состава С4Н7ОН.
- К перечисленным веществам: глицерин, бензол, фенол, толуол добавьте два так, чтобы в результате получилось три пары ближайших гомологов. Напишите формулы всех веществ и укажите пары гомологов.
- Напишите уравнение реакции получения гликоля из пентена-2.
- Как можно различить метилпропанол-2 и метилпропанол-1?
- Осуществите превращения:
а) 
б) 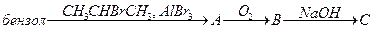
6. Какой объем водяного пара (н.у.) получится при дегидратации 5 кг пентанола-1, если выход реакции составляет 65%?
7. Какой объем кислорода потребуется для полного сгорания 28,75 л этанола и какая масса осадка получится при пропускании продуктов реакции через известковую воду?
Лабораторная работа 12
Альдегиды и кетоны.
Теоретические вопросы
1. Оксосоединения. Особенности строения карбонильной группы.
2. Альдегиды и кетоны. Номенклатура. Изомерия.
3. Способы получения альдегидов и кетонов: окисление первичных и вторичных спиртов, пиролиз солей карбоновых кислот с двухвалентными металлами, гидратация алкинов.
4. Нуклеофильное присоединение к карбонильной группе альдегидов и кетонов: реакции с HCN, гидросульфитом натрия, аммиаком, гидразином, магнийорганическими соединениями.
5. Качественная реакция на альдегиды и кислоты.
6. Восстановление альдегидов и кетонов.
7. Окисление альдегидов: взаимодействие с гидроксидом диамминсеребра и гидроксидом меди (II).
8. Окисление формальдегида.
9. Подвижность атома водорода в a-положении к карбонильной группе.
10. Альдольная и кротоновая конденсация.
11. Получение уротропина.
Экспериментальная часть
Цель работы – изучение химических свойств альдегидов и кетонов.
Опыт 1. Окисление формальдегида и ацетона гидроксидом диамминсеребра
Приготовление реактива Толленса. В чистую пробирку налейте 0,5 мл 1%-го раствора нитрата серебра и 0,5 мл 10%-го раствора гидроксида натрия. К выпавшему бурому осадку гидроксида серебра добавьте по каплям 10%-ный раствор аммиака до полного растворения осадка. Какое соединение серебра образуется в растворе? Запишите уравнения реакций.
Полученный раствор разделите на две пробирки. В одну из них добавьте 1 мл формалина (40%-ный раствор формальдегида в воде), а в другую 1 мл ацетона. Поместите обе пробирки на 5 минут в водяную баню, нагретую до 50оС. В каком случае металлическое серебро осаждается на стенках пробирки в виде блестящего налета (реакция "серебряного зеркала")? Сравните восстановительную активность формальдегида и ацетона. Уравнения реакций наблюдения и вывод запишите в лабораторный журнал.
Опыт 2.Окисление формальдегида и ацетона гидроксидом меди (II)
Приготовьте свежий раствор гидроксида меди (II). Для этого в пробирке смешайте 1 мл 2%-ного раствора сульфата меди (II) и 1 мл 10%-ного раствора гидроксида натрия. Отлейте половину получившегося раствора с осадком гидроксида меди (II) во вторую пробирку. Затем добавьте в 1-ю пробирку 10 капель раствора формалина, а во 2-ю – 10 капель ацетона. Пробирки по очереди осторожно нагрейте в пламени горелки до кипения. В какой из пробирок наблюдается изменение окраски? Чем это объясняется?
| Cu(OH)2 | CuOH | Cu2O | Cu |
| голубой | желтый | красный | «медное зеркало» |
Сравните реакционную способность формальдегида и ацетона. Наблюдения, уравнения реакций и выводы запишите в лабораторный журнал.
О пыт 3. Получение гидросульфитных производных альдегидов и кетонов
а) Взаимодействие бензальдегида с гидросульфитом натрия. В пробирку налейте 1 мл насыщенного раствора гидросульфита натрия и 0,5 мл бензальдегида. Смесь встряхните и охладите под струей холодной воды. Кристаллы поместите на предметное стекло и рассмотрите под микроскопом, зарисуйте их форму под микроскопом. Наблюдения, уравнение реакции запишите в журнал.
б) Взаимодействие ацетона с гидросульфитом натрия. На предметном стекле смешайте стеклянной палочкой 1 каплю насыщенного раствора гидросульфита натрия и 1 каплю ацетона. Образовавшиеся кристаллы рассмотрите под микроскопом, зарисуйте их форму, напишите уравнение реакции. В выводе сравните форму кристаллов в обоих опытах. Отметьте, с какой целью можно применять эту реакцию.
Типовые задачи
1. Приведите формулы двух веществ состава СnH2n-2O2, имеющих одинаковое значение «n» и только по одной альдегидной группе.
2. К перечисленным веществам: триметилфенол, бутаналь, изопропилфенол, этанол, бутанол добавьте одно. В результате должно получится три пары изомеров. Напишите формулы всех веществ и укажите пары изомеров.
3. Приведите примеры синтеза альдегидов из алкена, алкана, алкина. Укажите условия реакций.
4. В пробирке находится смесь гептана, гептанола и гептаналя. Опишите, как можно провести разделение этих веществ.
5. Напишите уравнения реакций взаимодействия любого триметилбутаналя с аммиачным раствором оксида серебра.
6. Напишите уравнения химических реакций взаимодействия: а) бензальдегида с гидроксидом меди (II); б) альдольной конденсации ацетона; в) метилэтилкетона с гидразином; г) пропанона с гидросульфитом натрия; д) кротоновой конденсации пропионового альдегида.
7. Аммиачный раствор оксида серебра обработали избытком формальдегида. По окончании реакции раствор обработали избытком соляной кислоты, при этом выделилось 560 мл газа (н.у.). Вычислите массу оксида серебра, которая была использована для приготовления его аммиачного раствора.
Лабораторная работа 13
Дата: 2019-02-02, просмотров: 453.