Теоретические основы . Если химическая реакция происходит между веществами, находящимися в растворах, то число эквивалентов вещества можно выразить через молярную концентрацию его эквивалента, то есть
n 1 = n 2 и Сн 1 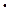 V1 = Сн 2
V1 = Сн 2 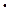 V2
V2
(закон эквивалентов для реакций в растворах).
Точное определение концентрации неизвестного раствора (стандартизация) проводится с помощью титрования - постепенного смешивания реагирующих веществ до достижения точки эквивалентности. В точке эквивалентности выполняется закон эквивалентов - реагирующие вещества содержатся в эквивалентных количествах.
Стандартизацию раствора соляной кислоты можно провести с помощью реакции с гидроксидом натрия:
HCl + NaOH = NaCl + H2O
Метод титрования, основанный на реакции нейтрализации (взаимодействие кислоты со щелочью) носит название кислотно-основное титрование (метод нейтрализации).
Раствор гидроксида натрия с точно известной концентрацией носит название рабочего (стандартного, титрованного) раствора.
Точку эквивалентности в процессе кислотно-основного титрования можно определить с помощью кислотно-основных индикаторов - веществ, изменяющих свой цвет при изменении реакции среды. Например, индикатор метилоранж в кислой среде имеет красную окраску, в нейтральной - оранжевую, а в щелочной среде - желтую.
Цель работы. Методом кислотно-основного титрования определить точную концентрацию приготовленного ранее раствора соляной кислоты. В качестве стандартного раствора использовать раствор гидроксида натрия, а в качестве индикатора - метилоранж. Измерив объем добавленного раствора кислоты, рассчитать его точную концентрацию.
Порядок работы.
1. Ознакомьтесь с установкой для титрования. Она состоит из бюретки, закрепленной в штативе. Капиллярный конец бюретки присоединен к ней резиновым шлангом с зажимом. Цена деления шкалы бюретки 0,1 мл. Пипетка представляет собой стеклянную трубку, утолщенную посередине. Она позволяет измерять точные фиксированные объемы (раствор заполняется до метки в верхней части пипетки).
2. Укрепите бюретку в штативе и промойте ее раствором кислоты: через воронку залейте в бюретку раствор кислоты выше нулевой отметки и затем слейте его полностью в стакан, ослабив для этого зажим бюретки.
3. Снова заполните бюретку раствором кислоты и заполните ее капиллярный конец, загнув его вверх для облегчения удаления воздуха.
4. Установите уровень раствора кислоты на нулевой метке.
5. В коническую колбу отмерьте из общей бюретки или пипеткой 10,0 мл стандартного раствора гидроксида натрия, добавьте цилиндром 25-30 мл дистиллированной воды и 2-3 капли метилоранжа, который в присутствии щелочи окрасится в желтый цвет.
6. Подставив колбу под бюретку, проведите титрование: добавляйте по каплям раствор кислоты, непрерывно перемешивая раствор. Титрование окончено, когда добавление очередной капли раствора NaOH изменит окраску раствора в колбе на оранжевую (красный цвет раствора означает, что добавлен избыток кислоты, титрование необходимо повторить).
7. Запишите объем кислоты в бюретке в таблицу (см. форму лабораторного отчета) с точностью до 0,1 мл.
8. Повторите титрование еще два раза, каждый раз доливая раствор кислоты в бюретке до нулевого уровня. Расхождение между измеренными объемами кислоты не должно превышать 0,1- 0,2 мл.
9. Рассчитайте молярную концентрацию эквивалента раствора соляной кислоты с точностью до 0,0001.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Уравнение реакции.
4. Экспериментальные данные:
| № опыта | 1 | 2 | 3 |
| Объем раствора кислоты, V, мл |
Объем раствора NaOH , VNaOH = 10,0 мл
Концентрация раствора NaOH , Cн (NaOH) = .......
1. Расчеты: 1) средний объем кислоты:
VHCl = 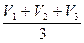 = ...
= ...
2) концентрация раствора кислоты:
Cн HCl = 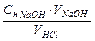 = ...
= ...
Типовые задачи и вопросы.
1. От каких перечисленных ниже факторов зависит в данном эксперименте объем раствора кислоты, необходимый для достижения точки эквивалентности:
а) число капель индикатора;
б) концентрация раствора кислоты;
в) объем дистиллированной воды, добавленной в колбу;
г) скорость титрования;
д) число эквивалентов щелочи в колбе?
2. Можно ли определить концентрацию раствора кислоты, если он при титровании будет находиться в колбе, а раствор щелочи - в бюретке? Как при этом будет меняться окраска индикатора?
3. При стандартизации раствора NaOH на титрование 10 мл его пошло 12,5 мл 0,0967 N раствора H2SO4. Вычислите концентрацию раствора NaOH.
4. 5,6000 г гидроксида калия оттитровали 15,4 мл раствора соляной кислоты. Вычислите нормальную концентрацию раствора кислоты.
5. 25,0 мл раствора серной кислоты оттитровали 5,3 мл 0,1265 н раствора гидроксида натрия. Вычислите массу серной кислоты в 2 л этого раствора.
6. Какой объем (мл) 0,4 Н раствора кислоты требуется для нейтрализации раствора, содержащего 0,24 г NaOH в 40 мл?
7. Для нейтрализации 20 мл 0,1 Н раствора кислоты потребовалось 8 мл раствора NaОН. Сколько граммов NaОН содержит 1 л этого раствора?
Семинар 2
Строение атома.
Периодический закон Д.И.Менделеева. Химическая связь.
1. Физический смысл и значение квантовых чисел.
2. Написать значения квантовых чисел для орбиталей: а) 3s; б) 4d; в) 5pх
3. Какое максимальное число электронов может находиться: а) на 5р-подуровне; б) в электронном слое с n=4?
4. Выберете невозможные конфигурации: 1p3, 3p6, 3s5, 2s2, 2d5, 5d2, 3f12, 2p4, 5p7
5. Правило Паули. Максимальное число электронов на орбитали, подуровне, уровне.
6. Правило наименьшей энергии.
7. Правило Клечковского. Графическая форма этого правила. Исключения из правила Клечковского для элементов I-IV периодов.
8. Правило Гунда.
9. Порядок написания подуровней в электронной формуле.
10. Электронные формулы положительного или отрицательного иона данного элемента.
11. Напишите электронные формулы атомов элементов Cl, Cu, Cr, Br.
12. Напишите электронные формулы ионов S2- и Mn2+
13. Определите возможные валентные состояния атомов хлора и фтора
14. Периодический закон Д.И.Менделеева. Физический смысл периодического закона.
15. Изменения радиусов атомов, их металлических и неметаллических свойств, их энергий ионизации и относительных электроотрицательностей в периодах и группах (главных подгруппах).
16. Какой элемент из пары имеет более высокую: а) энергию ионизации; б) энергию сродства к электрону; в) электроотрицательность (№ 8 и № 16; 3 11 и № 19; № 15 и № 16)
17. Типы химической связи: ковалентная, ионная, металлическая, водородная.
18. Ковалентная связь. Механизм образования ковалентной связи. Донорно-акцепторная связь.
19. Гибридизация атомных орбиталей. Расположение в пространстве sp-, sp2-, sp3 -гибридных орбиталей. Направленность ковалентной связи.
20. Определите характер связи и приведите схему образования: CaCl2; N2; HCl.(метод валентных связей)
21. Определите тип гибридизации, приведите схему образования и пространственное строение: ВеF2; BH3; CH4; NH3; NH4+; H2O; Н3О+. (метод валентных связей)
Лабораторная работа 4
Дата: 2019-02-02, просмотров: 347.