Типовые задачи
1. Напишите математическое выражение скоростей следующих реакций:
а) N2 + O2 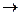 б) С + О2
б) С + О2 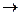 в) FeO + H2
в) FeO + H2 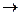
2. Напишите выражение константы равновесия химической реакции: 2А + В 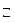 3С + 2D.
3С + 2D.
3. Найти значение константы скорости реакции А + В ® АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5,0×10-5 моль / л×мин ?
4. Как изменится скорость реакции 2СО + О2 ® 2СО2, если повысить концентрацию СО в 3 раза, а концентрацию О2 – в 2 раза?
5. Во сколько раз изменится скорость реакции 2А + В ® А2В, если концентрацию вещества А увеличить в 3 раза, а концентрацию вещества В уменьшить в 3 раза?
6. Как изменится скорость реакции 2NO + O2 ® 2NO2, если уменьшить давление в системе в 3 раза?
7. Во сколько раз в системе 2А2 + В2 ® 2А2В надо увеличить концентрацию вещества В2, чтобы при уменьшении концентрации вещества А2 в 4 раза скорость прямой реакции не изменилась?
8. Во сколько раз возрастет скорость реакции при повышении температуры от 10 до 500С, если температурный коэффициент ее скорости равен 2?
9. При повышении температуры от 20 до 500С скорость некоторой реакции возросла в 27 раз. Найти температурный коэффициент скорости данной реакции.
10. При 1500С некоторая химическая реакция заканчивается за 16 мин. За какое время эта реакция закончится при 1800С, если температурный коэффициент ее скорости равен 2?
11. При 1500С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости данной реакции равным 2, рассчитать, через какое время она закончится при 1700С.
12. В каком направлении сместится равновесие в системе Н2О + СО 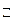 СО2 + Н2 при добавлении паров воды?
СО2 + Н2 при добавлении паров воды?
13. В каком направлении сместится равновесие в системе Ag+ + Cl- 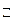 AgCl при добавлении хлорида натрия?
AgCl при добавлении хлорида натрия?
14. В каком направлении сместится равновесие в системе 2СО (г) + О2(г) 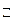 2СО2, DН0 = – 566 кДж а) при повышении давления; б) при понижении температуры?
2СО2, DН0 = – 566 кДж а) при повышении давления; б) при понижении температуры?
Лабораторная работа 2
Приготовление раствора соляной кислоты
Теоретические основы . Растворы - это гомогенные системы переменного состава. Они состоят из растворителя и растворенного вещества, соотношение между которыми определяется концентрацией раствора.
Способы выражения концентрации раствора:
а) массовая доля раствора (процентная концентрация) показывает массу растворенного вещества в 100 г раствора
 w =
w = 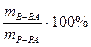
(например, 3%-ный раствор NaOH, раствор NaOH с w=3% или w =0,03);
б) молярная концентрация раствора (молярность) показывает количество растворенного вещества в 1 л раствора
 СМ =
СМ = 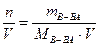
(например 2 М раствор HCl или раствор HСl с СМ = 2 моль/л);
в) молярная концентрация эквивалента (нормальная концентрация или нормальность) показывает количество эквивалентов вещества в 1 л раствора
 Cн =
Cн = 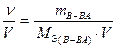
(например, 0,1н раствор НNO3 или раствор НNO3 c Cн =0,1 моль/л).
Цель работы. По плотности исходного раствора соляной кислоты, экспериментально определенной с помощью ареометра, найти по таблице его концентрацию. Рассчитать объем концентрированного раствора соляной кислоты и воды, необходимые для приготовления требуемого объема кислоты заданной концентрации. Приготовить раствор кислоты.
Порядок работы.
1. Налейте исходный раствор кислоты в цилиндр без делений примерно на половину его объема.
2. Осмотрите ареометры. Ареометр, рассчитанный на измерение меньших плотностей, опустите в раствор кислоты в мерном цилиндре. Если шкала ареометра полностью находится над поверхностью, замените его на другой - для измерения больших плотностей. Для снятия показаний на шкалу смотрят несколько снизу, сквозь толщу раствора. Верхняя видимая при этом метка соответствует плотности раствора (r).
3. В таблице зависимости плотности раствора от концентрации найдите массовую долю раствора соляной кислоты. При необходимости проведите интерполяцию.
4. Рассчитайте объемы исходного раствора Vисх и дистиллированной воды, необходимые для приготовления 250 мл 0,1 н раствора соляной кислоты.
5. Мерным цилиндром объемом 10 мл отмерьте в склянку рассчитанный объем исходного раствора НCl и мерным цилиндром объемом 250 мл - рассчитанный объем дистиллированной воды.
6. Закройте склянку пробкой и перемешайте содержимое, опрокидывая склянку не менее 20 раз.
7. На листе бумаги запишите: “HCl  0,1н”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
0,1н”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Задание: приготовить 250 мл 0,1 н раствора соляной кислоты. Образец концентрированной кислоты № ..... .
4. Характеристика исходного раствора соляной кислоты:
плотность r = .......
интерполяция: ........
массовая доля исходного раствора кислоты w = ...... .
5. Расчеты:
а) масса соляной кислоты, содержащаяся в 250 мл 0,1 N раствора соляной кислоты
mHCl = MЭ (HCl) 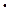 Cн
Cн 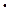 Vр-ра = .......
Vр-ра = .......
б) масса исходного раствора соляной кислоты, содержащая рассчитанное количество соляной кислоты
mисх .р-ра = 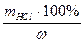 = ......
= ......
в) объем исходного раствора соляной кислоты
Vисх.р-ра = mисх. р-ра / r = ......
г) объем дистиллированной воды
Vводы = 250 - Vисх .р-ра
Типовые задачи и вопросы.
1. Почему, измеряя плотность жидкости, надо сначала использовать ареометр для измерения меньших плотностей?
2. На каком законе основано действие ареометра?
3. Какая масса серной кислоты содержится в 400 мл 0,2 N раствора?
4. Пользуясь данными таблицы зависимости плотности от массовой доли раствора и применив метод интерполяции, рассчитайте массовую долю раствора соляной кислоты с плотностью 1,163 г/мл.
5. В 600 г воды растворили 40 г хлорида калия. Вычислите массовую долю (%) хлорида калия в полученном растворе.
6. Сколько граммов воды содержится в 500 г 20% раствора бромида калия?
7. Определите массовую долю (%) СuSO4 в растворе, полученном при растворении 50 г медного купороса СuSO4·5Н2О в 450 г воды.
8. Найти массовую долю (%) азотной кислоты в растворе, в 1 л которого содержится 224 г HNO3 (r=1,12г/мл).
9. Из 400 г 50% (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе.
10. Найти массу (г) NaNO3, необходимую для приготовления 300 мл 0,2 М раствора.
11. Сколько граммов гидроксида калия нужно взять для приготовления 500 мл 2 Н раствора?
12. Какой объем (мл) 96 % серной кислоты (r=1,84 г/мл) надо взять для приготовления 1,2 л 0,5 М раствора?
13. Какой объем (мл) 2 М раствора Na2СO3 надо взять для приготовления 1 л 0,25 Н раствора?
14. Какой объем (л) 2н раствора H2SO4 потребуется для приготовления 500 мл 0,5 Н раствора?
Лабораторная работа 3
Строение атома.
Периодический закон Д.И.Менделеева. Химическая связь.
1. Физический смысл и значение квантовых чисел.
2. Написать значения квантовых чисел для орбиталей: а) 3s; б) 4d; в) 5pх
3. Какое максимальное число электронов может находиться: а) на 5р-подуровне; б) в электронном слое с n=4?
4. Выберете невозможные конфигурации: 1p3, 3p6, 3s5, 2s2, 2d5, 5d2, 3f12, 2p4, 5p7
5. Правило Паули. Максимальное число электронов на орбитали, подуровне, уровне.
6. Правило наименьшей энергии.
7. Правило Клечковского. Графическая форма этого правила. Исключения из правила Клечковского для элементов I-IV периодов.
8. Правило Гунда.
9. Порядок написания подуровней в электронной формуле.
10. Электронные формулы положительного или отрицательного иона данного элемента.
11. Напишите электронные формулы атомов элементов Cl, Cu, Cr, Br.
12. Напишите электронные формулы ионов S2- и Mn2+
13. Определите возможные валентные состояния атомов хлора и фтора
14. Периодический закон Д.И.Менделеева. Физический смысл периодического закона.
15. Изменения радиусов атомов, их металлических и неметаллических свойств, их энергий ионизации и относительных электроотрицательностей в периодах и группах (главных подгруппах).
16. Какой элемент из пары имеет более высокую: а) энергию ионизации; б) энергию сродства к электрону; в) электроотрицательность (№ 8 и № 16; 3 11 и № 19; № 15 и № 16)
17. Типы химической связи: ковалентная, ионная, металлическая, водородная.
18. Ковалентная связь. Механизм образования ковалентной связи. Донорно-акцепторная связь.
19. Гибридизация атомных орбиталей. Расположение в пространстве sp-, sp2-, sp3 -гибридных орбиталей. Направленность ковалентной связи.
20. Определите характер связи и приведите схему образования: CaCl2; N2; HCl.(метод валентных связей)
21. Определите тип гибридизации, приведите схему образования и пространственное строение: ВеF2; BH3; CH4; NH3; NH4+; H2O; Н3О+. (метод валентных связей)
Лабораторная работа 4
Типовые задачи.
1. Напишите уравнения реакций диссоциации следующих электролитов: AlCl3, H2SO3, NaHCO3. Для обратимых процессов запишите выражения констант равновесия.
2. Вычислите концентрацию ионов водорода в 0,1 М растворе соляной кислоты, если степень ее диссоциации равна 98%.
3. Закончите уравнения реакций, расставьте коэффициенты, запишите уравнения в ионно-молекулярной и сокращенной форме:
| а) AgNO3 + BaCl2 ® | б) Ca(OH)2 + HCl ® |
| в) Na2SO3 + H2SO4 ® | г) CaCO3 + HNO3 ® |
| д) K2SO4 + NaOH ® | e) Pb(OH)2 + KOH ® |
| ж)Al2(SO4)3+NaOH(изб.)® | з) AgNO3 + H2S ® |
4. Вычислите ионную силу раствора, содержащего смесь 0,01 М AlCl3 и 0,1 М Na2SO4.
5. Вычислите ионную силу раствора, содержащего смесь 0,01 М Cr2(SO4)3 и 1М NaCl.
6. Вычислите активность ионов Са2+ в 0,1 М растворе СаСl2.
7. Вычислите активность ионов Nа+ в 0,1 М растворе Nа3PO4.
8. Константа диссоциации масляной кислоты составляет 1.5 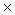 10
10 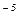 . Рассчитайте степень ее диссоциации и рН в 0,005 М растворе.
. Рассчитайте степень ее диссоциации и рН в 0,005 М растворе.
9. Вычислите концентрацию ацетат-ионов в 0,1 М растворе уксусной кислоты в присутствии 0,01 моль соляной кислоты.
10. Напишите в молекулярном и ионном виде уравнения реакций доказывающих амфотерный характер: Be(OH)2, Cr(OH)3, Pb(OH)2.
Лабораторная работа 5
Типы реакций гидролиза.
1. Соль образована ионами сильного основания и сильной кислоты (например, NaCl, KNO3 и др.).
NaCl + H2O 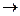 гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
гидролиз не идет (NaOH - сильное основание, HCl - сильная кислота).
2. Соль образована ионами сильного основания и слабой кислоты (например, Na2CO3, KSCN и др.).
Na2CO3 + Н2О 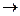 гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
гидролиз по аниону (NaOH - сильное основание, H2CO3 - cлабая кислота).
CO32  + HOH
+ HOH 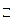 HCO3
HCO3  + OH
+ OH  (среда щелочная, рН>7).
(среда щелочная, рН>7).
Na2CO3+ HOH 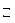 NaHCO3 + NaOH (1 ступень гидролиза).
NaHCO3 + NaOH (1 ступень гидролиза).
Добавление к раствору сильных щелочей (NaOH), содержащих одноименные ионы (OH  ), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH
), вызывает ослабление гидролиза (смещение равновесия влево по принципу Ле Шателье). Добавление к раствору кислот усиливает гидролиз за счет реакции Н++OH 
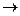 Н2О, в результате которой концентрация ионов OH
Н2О, в результате которой концентрация ионов OH  в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
в растворе уменьшается, и равновесие гидролиза смещается вправо. Гидролиз усиливается и начинает идти по второй ступени:
Н CO 3  + HOH
+ HOH  H 2 CO 3 + OH
H 2 CO 3 + OH 
Na Н CO 3 + HOH 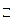 H 2 CO 3 + NaOH (2 ступень гидролиза).
H 2 CO 3 + NaOH (2 ступень гидролиза).
3. Соль образована ионами слабого основания и сильной кислоты (например, AlCl3, FeSO4 и др.).
AlCl3 + H2O 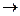 гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
гидролиз по катиону (Al(OH)3 - слабое основание, НCl - cильная кислота).
Al3+ + HOH 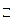 AlOH2+ + H+ (среда кислая, рН<7)
AlOH2+ + H+ (среда кислая, рН<7)
AlCl3 + HOH 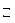 AlOHCl2 + HCl (1 ступень гидролиза).
AlOHCl2 + HCl (1 ступень гидролиза).
4. Соль образована ионами слабого основания и слабой кислоты:
а) соль растворима в воде (например, (NH4)2CO3, NH4NO2 и др.).
(NH4)2CO3 + H2O 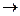 гидролиз идет сразу по катиону и аниону:
гидролиз идет сразу по катиону и аниону:
2NH4+ + CO32  + HOH
+ HOH 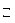 NH4OH + HCO3
NH4OH + HCO3  + NH4+
+ NH4+
( рН  7)
7)
(NH4)2CO3 + HOH 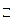 NH4OH + NH4HCO3
NH4OH + NH4HCO3
б) соль нерастворима в воде (например, FeS, ZnSiO3 и др.).
FeS + H2O 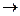 нерастворимые соли гидролизу не подвергаются;
нерастворимые соли гидролизу не подвергаются;
в) соль разлагается водой (в таблице растворимости стоит прочерк, например, Fe2S3, Al2(CO3)3 и др.). Гидролиз таких солей идет необратимо и до конца: Fe2S3+6H2O 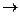 2Fe(OH)3
2Fe(OH)3 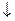 +3H2S
+3H2S 
Цель работы. C помощью универсальной индикаторной бумаги определить реакцию среды водных растворов солей, изучить влияние температуры и концентрации на гидролиз, взаимное усиление гидролиза растворов различных солей.
Порядок работы.
Опыт 1. Определение рН в кислых, щелочных и
нейтральных средах
На предметное стекло положите небольшие кусочки универсальной индикаторной бумаги и стеклянными палочками нанесите на них по капле дистиллированной воды, растворов NaOH, NH4OH, HCl, CH3COOH. С помощью цветовой шкалы определите рН в нейтральной, щелочной и кислой средах.
Опыт 2. Определение реакции среды при гидролизе солей
В отдельные пробирки добавьте по нескольку кристалликов следующих солей: нитрата натрия, сульфита натрия, нитрата цинка, ацетата аммония. Растворите соли в 1-2 мл дистиллированной воды. На предметное стекло положите кусочки универсальной индикаторной бумаги и определите рН растворов солей.
Опыт 3. Влияние температуры на гидролиз
Налейте в пробирку 3-4 мл раствора ацетата натрия и добавьте 1-2 капли фенолфталеина. Разделите раствор на 2 пробирки и одну из них нагрейте на водяной бане. Сравните интенсивность окраски индикатора в обеих пробирках.
Опыт 4. Влияние концентрации раствора соли на гидролиз
Налейте в пробирку 1 мл раствора хлорида сурьмы и добавьте дистиллированной воды. Выпадение белого осадка связано с разложением хлорида дигидроксосурьмы, образующейся за счет гидролиза соли по второй ступени: Sb(OH)2Cl 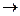 SbOCl
SbOCl 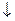 + H2O
+ H2O
Добавьте в пробирку раствор соляной кислоты до растворения осадка. Объясните смещение равновесия реакции гидролиза.
Опыт 5. Взаимное усиление гидролиза
Налейте в пробирку 1 мл раствора хлорида алюминия и добавьте равное количество раствора карбоната натрия. Объясните взаимное усиление гидролиза солей, приводящее к выделению оксида углерода (IV) и образованию осадка гидроксида алюминия. Используя амфотерные свойства гидроксида алюминия, докажите его образование.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
Опыт 1. Определение рН в кислых, щелочных и
нейтральных средах
| Исследуемое вещество | Цвет универсальной индикаторной бумаги | рН | Реакция среды |
Опыт 2. Определение реакции среды при гидролизе солей
| Исследуемое вещество | рН раствора | Реакция среды | Уравнение реакции гидролиза соли в молекулярном и ионном видах |
Опыты 3-5 оформите по схеме:
а) название опыта;
б) уравнение реакций в молекулярной и ионной формах;
в) наблюдения и обсуждения;
г) выводы.
Типовые задачи.
1. Напишите в молекулярной и ионно-молекулярной формах уравнения реакций гидролиза следующих солей: ZnCl2, Fe(NO3)3, CH3COOK, MnSO4, Na3PO4, K2S, NH4Cl, (NH4)2CO3, Al2S3. Укажите реакцию среды.
2. Рассчитайте концентрацию ионов водорода в водном растворе, в котором концентрация ионов ОН- равна 3,9×10-9 моль/л.
3. Найти рН 0,0001 М раствора КОН при условии его полной диссоциации.
4. Найти рН 0,1 М раствора соляной кислоты при условии ее полной диссоциации.
5. Найти рН 0,005 М раствора H2SO4 при условии полной диссоциации.
6. Найти рН 0,5 М раствора Ва(ОН)2 при условии полной диссоциации.
7. Найти рН и степень диссоциации 0,1 М раствора СН3СООН, если константа ее диссоциации К = 1,8 10-5.
8. Найти рН и степень диссоциации 0,001 М раствора NH4OH, если константа его диссоциации К = 1,75 10-5.
9. Найти рОН 0,079 M раствора НСN (К= 7,9 ·10-10).
10. Найти рОН 0,05 M раствора НСlО (К= 5 ·10-8).
11. Смешали 1 л 0,001 М раствора азотной кислоты и 1 л 0,0008 М раствора гидроксида натрия. Найти рН полученного раствора.
12. Смешали 1 л 0,03 М раствора HCl и 1 л 0,028 М раствора КОН. Найти рН полученного раствора.
Лабораторная работа 6
Буферные растворы
Теоретические основы . Буферные растворы используют для поддержания постоянной величины рН в исследуемом растворе при добавлении к нему небольших количеств сильной кислоты, сильного основания или при разбавления раствора.
В качестве буферных растворов обычно используют смеси растворов слабых кислот или слабых оснований и их солей или смеси солей многоосновных кислот различной степени замещения. В таблице приведены примеры наиболее часто используемых буферных растворов и величины рН, которые они поддерживают:
| Состав буферного раствора | Название буфера | рН |
| Смесь СН3СООН и СН3СООNа | Ацетатный буфер | 4,7 |
| Смесь NаН2РО4 и Nа2НРО4 | Фосфатный буфер | 6,5 |
| Смесь NН4ОН и NН4С1 | Аммиачный буфер | 9,25 |
Буферная система может связывать как ионы Н+, так и ОН- приливаемых сильных кислот и оснований в слабые электролиты, незначительно изменяя величину рН раствора.
Пример: Ацетатный буферный раствор содержит смесь CH3COOH и CH3COONa. Диссоциация слабого электролита – уксусной кислоты – отражается уравнением реакции: CH3COOH 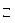 CH3COO
CH3COO  + H+ и описывается константой равновесия:
+ H+ и описывается константой равновесия:
Ka= 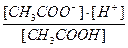 = 1.8 10
= 1.8 10 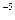
При добавлении ацетата натрия концентрация ионов CH3COO  возрастает и определяется концентрацией соли: [CH3COO
возрастает и определяется концентрацией соли: [CH3COO  ]
] 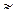 Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH]
Cс. Диссоциация слабого электролита уменьшается за счет введения одноименного иона, поэтому [CH3COOH] 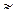 Cк, где Cк – концентрация кислоты.
Cк, где Cк – концентрация кислоты.
Ka= 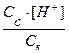 ;
;
[H+] = Ka  ;
;
pH = -lg[H+] = pKa - lg (  ),
),
где pKa = - lg Ka .
Таким образом, рН буферных растворов не зависит от концентраций компонентов, а определяется их отношением.
При добавлении небольших количеств сильных кислот и оснований компоненты буферного раствора реагируют с ними, переводя их в слабые электролиты:
CH3COOH + NaOH = CH3COONa + H2O (концентрация соли увеличивается на концентрацию добавленной щелочи, а концентрация кислоты уменьшается на ту же величину):
pH = -lg[H+] = pKa - lg ( 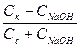 );
);
CH3COONa + HCl = CH3COOH + NaCl,
pH = -lg[H+] = pKa - lg ( 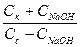 ).
).
Так как отношение концентраций изменяется меньше, чем их сумма или разность, общее значение рН изменяется незначительно.
Количество сильной кислоты или сильного основания, которые нужно добавить к буферному раствору для изменения рН одного литра его раствора на единицу, называют буферной емкостью ( B ). Она может быть вычислена относительно кислоты (B а) или основания (Bb).
Ba = 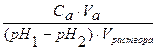
Bb = 
где Ba и Bb – буферные емкости по кислоте и основанию соответственно; Ca и Cb – концентрации добавленных кислоты и основания; pH 1 и pH 2 – исходные и конечные значения рН раствора; Va and Vb – объемы добавленных сильных кислоты и основания.
Цель работы. Изучить свойства буферных растворов.
Порядок работы.
Опыт. Определение рН буферных растворов
1. Приготовьте ацетатные буферные растворы, содержащие различные количества компонентов, согласно приведенной таблице:
|
| Буферный раствор | |||
| 1 | 2 | 3 | 4 | |
| Объем кислоты, мл | 10 | 18 | 6 | 2 |
| Объем соли, мл | 10 | 2 | 14 | 18 |
| Cк/Cс=Vк /Vс | ||||
| pH (измеренный) | ||||
| pH (рассчитанный) | ||||
2. Используя рН-метр, измерьте рН буферных растворов и занесите результаты в таблицу.
3. Используя теоретические формулы, рассчитайте рН буферных растворов и занесите результаты в таблицу. Сравните полученные результаты.
Форма лабораторного отчета
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Номер и название опыта.
4. Заполненная таблица.
5. Расчеты рН и буферной емкости.
6. Обсуждения.
7. Выводы.
Типовые задачи.
1. Напишите уравнения реакций, происходящих в аммиачном буферном растворе при добавлении к нему небольших количеств а) - соляной кислоты и б) - гидроксида натрия.
2. Вычислите рН формиатного буферного раствора, содержащего в 1 л 0,1 моль муравьиной кислоты и 0,01 моль формиата калия.
3. Вычислите рН аммиачного буферного раствора, содержащего 1 М раствор гидроксида аммония и 0,001 М раствор хлорида аммония.
4. Вычислите рН аммиачного буферного раствора, содержащего в 500 мл 5,25 г гидроксида аммония и 4,01 г хлорида аммония.
5. Вычислите рН ацетатного буферного раствора, содержащего в 1 л 0,25 моль уксусной кислоты и 0,12 моль ацетата натрия после добавления к нему 0,02 моль гидроксида калия.
6. После добавления 5 мл 0,1 М раствора соляной кислоты к 100 мл ацетатного буферного раствора его рН изменился от 4,50 до 4,35. Вычислите буферную емкость раствора.
7. Как изменится рН при добавлении 1 мл 1 М раствора HСl: а) к 100 мл Н2О; б) к 100 мл буферной смеси, содержащей 0,1 М СН3СООН и 0,1 М СН3СООNа. Изменением объема можно пренебречь.
Лабораторная работа 7
Коллоидные растворы
Теоретические основы. Коллоидные системы – это ультрамикрогетерогенные системы, состоящие из двух фаз: дисперсионной среды и дисперсной фазы. Дисперсная фаза коллоидных растворов состоит из молекулярных агрегатов размером 10 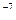 - 10
- 10 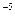 cм.
cм.
Комплексные соединения
Теоретические основы. Комплексными соединениями называются соединения, которые образованы из отдельных, способных к самостоятельному существованию сравнительно простых химических частиц (катионов, анионов, молекул). Примерами комплексных соединений могут служить Na3[Co(NO2)6]; [Cu(NH3)4]SO4; K4[Fe(CN)6].
Один из атомов комплексного соединения, обычно положительно заряженный катион металла, занимает центральное место в комплексе (центральный ион или ион-комплексообразователь). Нейтральные молекулы или ионы с противоположным зарядом (лиганды) образуют с центральным ионом химические связи по донорно-акцепторному механизму. Центральный ион и лиганды образуют внутреннюю сферу комплексного соединения (комплексный ион). Противоположно заряженные ионы, электростатически связанные с комплексным ионом и нейтрализующие его заряд, носят название внешней сферы комплекса.
Общее число химических связей, которые образует с лигандами ион-комплексообразователь, называется координационным числом центрального иона. Число химических связей, образованных одним лигандом с центральным атомом, называется дентатностью лиганда. Выделяют моно-, би- и полидентатные лиганды.
Большинство комплексных соединений являются электролитами. В растворах они необратимо диссоциируют на внутреннюю и внешнюю сферу (первичная диссоциация):
[Cu(NH3)4]SO4 
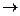 [Cu(NH3)4]2+ + SO42
[Cu(NH3)4]2+ + SO42 
Комплексный ион способен к вторичной диссоциации и является слабым электролитом (обратимая и ступенчатая диссоциация):
[Cu(NH3)4]2+ 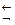 [Cu(NH3)3]2+ + NH3
[Cu(NH3)3]2+ + NH3
[Cu(NH3)3]2+ 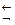 [Cu(NH3)2]2+ + NH3
[Cu(NH3)2]2+ + NH3
[Cu(NH3)2]2+  [Cu(NH3)]2+ + NH3 [Cu(NH3)]2+
[Cu(NH3)]2+ + NH3 [Cu(NH3)]2+ 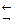 Cu2+ + NH3
Cu2+ + NH3
Суммарный процесс:
[Cu(NH3)4]2+ 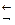 Cu2+ + 4NH3
Cu2+ + 4NH3
Каждый из этих обратимых процессов характеризуется константой равновесия, которая носит название константа нестойкости комплексного иона (ступенчатая или общая). Чем меньше величина константы нестойкости, тем более устойчиво комплексное соединение.
Смещение равновесие реакции диссоциации комплексного иона подчиняется всем описанным ранее правилам смещения химического равновесия: равновесие смещается в сторону более полного связывания молекул и ионов в растворе в молекулы или ионы слабых электролитов (равновесие химической реакции смещается в сторону образования более устойчивого комплексного соединения).
В соответствии с характером диссоциации комплексных соединений выделяют анионные, катионные или нейтральные комплексы.
В катионных комплексах внутренняя сфера имеет положительный заряд (комплексный катион). Лигандами в этом случае обычно являются нейтральные молекулы: [Cr(H2O)6]Cl3, [Co(NH3)6]Cl3.
В анионных комплексах комплексный ион заряжен отрицательно, в качестве лигандов выступают анионы: K2[HgI4], Na[Sb(OH)6].
Лигандами в нейтральных комплексах являются как анионы, так и нейтральные молекулы: [Pt(NH3)2Cl2]. Внешняя сфера отсутствует и первичная диссоциация не происходит.
Цель работы. Изучение свойств комплексных соединений и их реакций в растворах.
Порядок работы.
Опыт 1. Образование комплексных соединений.
Налейте в отдельные пробирки по 5-6 капель солей меди (II), никеля (II) и цинка. По каплям добавляйте раствор NH4OH. Запишите цвета образующихся осадков. Добавьте в пробирки избыток гидроксида аммония и наблюдайте процессы образования комплексных аммиакатов. Оставьте пробирки для следующего опыта. Запишите уравнения реакций образования комплексных соединений. Выпишите значения их констант нестойкости и сравните устойчивость комплексных соединений.
Опыт 2. Разрушение комплексных соединений под действием сильных электролитов.
По каплям добавьте к растворам комплексных аммиакатов, полученных в опыте 1, разбавленную азотную кислоту и наблюдайте процессы разрушения комплексов. Запишите уравнения реакций.
Опыт 3. Образование и свойства комплексных соединений Cd2+ и Hg2+.
Налейте в отдельные пробирки по 5-6 капель солей Cd2+ и Hg2+. По каплям добавляйте насыщенный раствор Na2SO3. Наблюдайте образование осадков сульфитов металлов и их дальнейшее растворение с образованием комплексных соединений типа Na2[M(SO3)2], M= Cd2+ или Hg2+.
Добавьте к растворам комплексных соединений раствор NaOH. Выпадают ли осадки гидроксидов кадмия и ртути? Сравните константы нестойкости комплексных ионов и сделайте вывод.
Опыт 4. Диссоциация комплексных соединений и двойных солей.
а). Налейте в три отдельные пробирки по 5-6 капель двойной соли NH4Fe(SO4)2.
В первую пробирку добавьте 3-4 капли концентрированного раствора гидроксида натрия NaOH, нагрейте пробирку и понюхайте выделяющиеся пары. Запишите наблюдения.
Во вторую пробирку добавьте 2-3 капли раствора BaCl2 , а в третью – раствора KSCN. Запишите наблюдения и сделайте вывод о диссоциации двойной соли. Запишите все уравнения химических реакций.
б). Налейте в две отдельные пробирки по 3-5 капель раствора K3[Fe(CN)6] и добавьте в них соответственно по 2-3 капли Na3[Co(NO2)6] и KSCN. Запишите наблюдения. Сделайте вывод о характере диссоциации комплексного соединения. (Примечание: в присутствии ионов K+ образуется желтый осадок K2Na[Co(NO2)6] ).
Типовые задачи.
1. Для следующих комплексных соединений укажите: (a) состав внутренней и внешней сферы; (б) ион-комплексообразователь, его заряд и координационное число; (в) лиганды и их дентатность; (г) запишите уравнения реакций первичной и вторичной диссоциации и выражение константы нестойкости комплексного иона; (д) назовите комплексные соединения: [Cd(NH3)4]Cl2; K2[Cd(CN)4]
2. Какое из приведенных выше комплексных соединений наиболее устойчиво?
3. Определите тип гибридизации атомных орбиталей и пространственное строение комплексного иона [Ag(NH3)2]+.
4. Вычислить концентрацию ионов кадмия в 0,1 м растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л KCN.
5. Рассчитайте концентрацию ионов серебра в 0,1 M растворе комплексного соединения хлорида диамминсеребра (а) в чистой воде; (б) в присутствии избытка аммиака с концентрацией 1 моль/л.
6. В каком случае возможна реакция обмена лигандов во внутренней сфере комплексных соединений? Запишите уравнения реакций в молекулярном и ионном видах и рассчитайте константу равновесия реакций:
a) K2[HgI4] + KCN =
б)K[Ag(CN)2] + NH3 =
Лабораторная работа 9
Азотная кислота
NO3  + 10H+ + 8e = NH4+ + 3H2O
+ 10H+ + 8e = NH4+ + 3H2O
NO3  + 4H+ + 3e = NO + 2H2O
+ 4H+ + 3e = NO + 2H2O
NO3  + 3H+ + 2e = HNO2 + H2O
+ 3H+ + 2e = HNO2 + H2O
NO3  + 2H+ + e = NO2 + H2O
+ 2H+ + e = NO2 + H2O
Соединения марганца
MnO4  + 8H+ + 5e = Mn2+ + 4H2O
+ 8H+ + 5e = Mn2+ + 4H2O
MnO4  + 2 H2O + 3e = MnO2 + 4OH
+ 2 H2O + 3e = MnO2 + 4OH 
MnO4 
 + e = MnO42
+ e = MnO42 
Соединения хрома
Cr2O72  + 14H+ + 6e = 2Cr3+ + 7H2O
+ 14H+ + 6e = 2Cr3+ + 7H2O
CrO42  + 4H2O + 3e = Cr(OH)63
+ 4H2O + 3e = Cr(OH)63  + 2OH
+ 2OH 
Пероксид водорода
H2O2 + 2e = 2OH 
H2O2 + 2H+ + 2e = 2H2O
2H+ + O2 + 2e = H2O2
2H2O + O2 + 2e = H2O2 + 2OH 
Цель работы. Изучение окислительно-восстановительных свойств различных веществ, типов окислительно-восстановительных реакций, а также методов составления уравнений окислительно-восстановительных реакций (ОВР).
Порядок работы.
Опыт 1. Окислительные свойства перманганата калия в различных средах.
В три пробирки налейте по 5 капель раствора KMnO4. Затем в первую добавьте 5 капель 2N раствора серной кислоты, во вторую - 5 капель дистиллированной воды, а в третью - 5 капель 2N раствора щелочи.
После этого во все три пробирки добавьте по каплям раствор сульфита натрия Na2SO3 до видимого изменения цвета растворов.Напишите уравнения реакций, рассчитайте их электродвижущую силу.
Опыт 2. Окислительные свойства дихромата калия (Cr +6)
Налейте в пробирку 1-2 мл дихромата калия К2Cr2O7 , 3 мл раствора 2N серной кислоты и 1 мл раствора иодида калия КI . Отметьте изменение окраски и докажите с помощью крахмального клейстера выделение свободного иода. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
Опыт 3. Восстановительные свойства иона Cr +3.
Налейте в пробирку 1-2 мл раствора соли трехвалентного хрома, добавьте по каплям раствора щелочи до растворения образующегося осадка Cr(OH)3 и затем по каплям раствор пероксида водорода до изменения окраски раствора. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
Опыт 4. Окислительно-восстановительные свойства пероксида водорода.
a). Налейте в пробирку 3 капли раствора KI, добавьте 2 капли разбавленной серной кислоты и 3 капли 3%-ного раствора H2O2. Наблюдайте изменение цвета раствора. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
б). Налейте в пробирку 6 капель раствора KMnO4, добавьте 2 капли разбавленной серной кислоты и по каплям 3%-ный раствор H2O2 до исчезновения окраски раствора перманганата калия. Наблюдайте выделение кислорода. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
Опыт 5. Окисление катиона d-элемента.
Налейте в пробирку 2 капли раствора соли марганца (II), добавьте 5-6 капель разбавленной азотной кислоты и несколько кристалликов висмутата натрия NaBiO3. Наблюдайте появление малиновой окраски HMnO4. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
Опыт 6. Восстановительные свойства р-элементов.
Налейте в пробирку 3-4 капли раствора SnCl2, добавьте NaOH до растворения осадка и 2-3 капли раствора нитрата висмута (III) Bi(NO3)3. Наблюдайте выделение металлического висмута. Напишите уравнение реакции, рассчитайте ее электродвижущую силу.
Типовые задачи.
1. Закончите уравнения окислительно-восстановительных реакций, расставьте коэффициенты:
1) K2S + KMnO4 + H2SO4 =
2) KI + K2Cr2O7 + H2 SO4 =
3) KMnO4 + H2O2 =
2. Определите направление протекания окислительно-восстановительных реакций:
1) H2O2 + HClO = HCl + O2 + H2O
2) H3PO4 + 2HI = H3PO3 + I2 + H2O
3. Определите, можно ли восстановить соль железа (III) до железа (II) в водном растворе с помощью (a) бромида калия, (b) иодида калия?
4. Рассчитайте константы равновесия следующих окислительно-восстановительных реакций:
1) Zn + CuSO4 = Cu + ZnSO4
2) Sn + Pb(CH3COO)2 = Sn(CH3COO)2 + Pb
Семинар 3
Экспериментальная часть
Цель работы – изучение химических свойств предельных и непредельных углеводородов.
Внимание! Опыты выполняются в вытяжном шкафу!
Опыт 1 . Получение метана и изучение его свойств.
а) Получение метана. Смесь безводного ацетата натрия и натронной извести в соотношении 6:10 тщательно перемешайте и поместите в пробирку, горизонтально закрепленную в лапке штатива. Пробирку закройте пробкой с газоотводной трубкой. Метан получают нагреванием реакционной смеси в пробирке по реакции:

б) Химические свойства метана. Для изучения химических свойств метана налейте в две пробирки по 0,5 мл 2%-м раствора перманганата калия и бромной воды. Пробирку с газоотводной трубкой, в которой помещен метан, осторожно нагрейте, постепенно усиливая нагревание. Конец газоотводной трубки опустите на 1-2 минуты в раствор перманганата калия, затем на такое же время - в бромную воду. В лабораторном журнале отметьте, изменилась ли окраска растворов в пробирках. Сделайте вывод о взаимодействии метана с водными растворами окислителя и галогена.
в) Горение метана. Не прекращая нагревание реакционной смеси, подожгите метан у конца газоотводной трубки, затем прекратите нагревание пробирки. Запишите уравнение реакции и отметьте цвет пламени горящего метана.
Опыт 2.Получение этилена и изучение его свойств.
а) Получение этилена. В сухую пробирку поместите 1 мл этанола, 3 мл концентрированной серной кислоты и несколько фарфоровых кипелок, необходимых для равномерного кипения при нагревании. Пробирку закройте пробкой с газоотводной трубкой и, чтобы жидкость не вылилась, закрепите на штативе под углом к поверхности стола. Этилен получают нагреванием реакционной смеси по реакции:

б) Химические свойства этилена. Для изучения химических свойств этилена так же, как в опыте 1б, приготовьте две пробирки с растворами перманганата калия и бромной воды по 0,5 мл. Пробирку с газом осторожно нагрейте, конец газоотводной трубки опустите на 1-2 минуты в раствор перманганата калия, затем на такое же время - в бромную воду. Напишите уравнения реакций, отметьте, изменилась ли окраска растворов. Сделайте вывод о взаимодействии этилена с водными растворами окислителя и галогена.
Опыт 3. Взаимодействие бензола и толуола с перманганатом калия.
а) Окисление бензола. Налейте в пробирку с 1 мл бензола и добавьте туда 1 мл водного раствора перманганата калия. Смесь энергично встряхивайте 20-30 секунд. Отметьте в лабораторном журнале, происходит ли обесцвечивание раствора? Сделайте вывод, объяснив причину.
б) Окисление толуола. Смешайте в пробирке 0,5 мл толуола, 2 мл водного раствора перманганата калия и 2 мл 10%-ного раствора серной кислоты. Смесь необходимо встряхивать до обесцвечивания перманганата калия. Запишите наблюдения и реакцию окисления толуола до бензойной кислоты. В выводе объясните, почему, в отличие от предыдущего опыта, окисление происходит.
Типовые задачи
- С помощью какой реакции можно отличить пропен от пропина?
- Как из метана получить бензол? Составьте уравнения всех реакций и укажите условия их протекания.
- Какие углеводороды можно получить при действии металлического натрия на смесь хлорэтана и 2-хлорпропана?
- Напишите реакцию полимеризации 2-метилбутадиена-1,3.
- Осуществите следующие превращения:
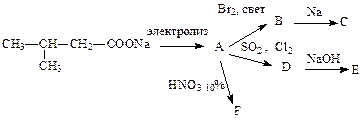
- При пропускании смеси этилена с метаном через склянку с бромной водой, масса склянки увеличилась на 8 г. Сколько литров и какого газа поглощено бромной водой?
- Определить молекулярную формулу углеводорода, если при полном сгорании 0,1 моля этого вещества образовалось 13,44 л оксида углерода (IV).
- Какое бромпроизводное будет предпочтительно получаться при бромировании этилбензола в присутствии металлического железа?
- С помощью какой реакции можно отличить бензол от циклогексена?
- Во сколько стадий можно получить нитробензол из карбида кальция? Составьте уравнения всех реакций и укажите условия их протекания.
- Сколько литров ацетилена необходимо взять для получения 100 г. бензола, если выход продукта составляет 60% от теоретического?
- Какой объем воздуха потребуется для полного сгорания 46 г. толуола (считать, что в воздухе содержится 20% кислорода).
- Осуществите следующие превращения:
1)

2)
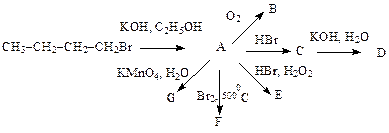
Лабораторная работа 11
Спирты. Фенолы
Теоретические вопросы
1. Одноатомные спирты. Номенклатура, изомерия. Первичные, вторичные и третичные спирты.
2. Особенности строения гидроксильной группы. Физические свойства спиртов. Водородная связь.
3. Способы получения одноатомных спиртов.
4. Химические свойства одноатомных спиртов: взаимодействие с натрием, замена гидроксильной группы на галоген, внутри- и межмолекулярная дегидратация.
5. Простые эфиры: получение, гидролиз.
6. Особенности реакций окисления первичных, вторичных и третичных спиртов.
7. Многоатомные спирты: этиленгликоль, глицерин.
8. Способы получения многоатомных спиртов.
9. Взаимодействие многоатомных спиртов с натрием и гидроксидом натрия.
10. Получение 1,4-диоксана из этиленгликоля.
11. Качественная реакция на многоатомные спирты.
12. Фенолы: строение, методы получения, физические свойства.
13. Химические свойства фенола.
14. Активность фенола в реакциях электрофильного замещения (конденсация фенола с формальдегидом).
15. Многоатомные фенолы: гидрохинон, резорцин, пирокатехин, пирогаллол.
16. Ароматические спирты.
17. Понятие о тиоаналогах спиртов и простых эфиров: меркаптаны, диалкилсульфиды.
Экспериментальная часть
Цель работы – изучение химических свойств одно- и многоатомных спиртов и фенолов.
Опыт 1. Растворимость спиртов в воде.
Возьмите три пробирки и налейте в них по 5 мл дистиллированной воды. В первую добавьте 1 мл этилового спирта, во вторую – 1мл бутилового спирта, в третью – 1 мл амилового спирта. Хорошо встряхните каждую пробирку. Запишите наблюдения и сделайте вывод о растворимости спиртов в зависимости от места в гомологическом ряду. Разделите каждый водно-спиртовый раствор на две пробирки и добавьте в одну из них по 2-3 капли фенолфталеина, а в другую – 2-3 капли метилоранжа. Наблюдается ли изменение окраски индикаторов? Сделайте вывод о кислотно-основных свойствах спиртов.
Опыт 2. Окисление спиртов.
а) Горение спиртов (выполняется в вытяжном шкафу!). В 3 фарфоровые чашки налейте по 1 мл этилового, бутилового и амилового спиртов. Поочерёдно подожгите содержимое. Проследите за характером пламени во всех трёх чашках. Уравнения реакций и наблюдения запишите в лабораторный журнал.
б) Окисление этанола. В сухой пробирке смешайте 2 капли этанола, 2 капли раствора бихромата калия и 1 каплю 10%-ного раствора серной кислоты. Реакционную смесь слегка нагрейте над пламенем горелки до начала изменения цвета. Через несколько секунд появляется зелёная окраска, характерная для солей хрома (III). Остывшую пробирку осторожно понюхайте: образовавшийся ацетальдегид обладает характерным запахом (зеленых яблок). Наблюдения и уравнение реакции запишите в лабораторный журнал.
Опыт 3. Получение хелатных комплексов многоатомных спиртов (гликолятов).
Приготовьте свежий раствор гидроксида меди (II). Для этого в пробирке смешайте 5 капель 2%-ного раствора сульфата меди (II) и 5 капель 10%-ного раствора гидроксида натрия. Отлейте половину получившегося раствора с осадком гидроксида меди (II) во вторую пробирку. В первую пробирку добавьте 1 каплю этиленгликоля и встряхните. Во вторую – 1 каплю глицерина, и тоже встряхните. Происходит ли растворение осадка? Какой цвет у полученного раствора? Наблюдения запишите в лабораторный журнал. Составьте схемы реакций, сделайте вывод о том, какой структурный фрагмент должен содержаться в молекулах спиртов, взаимодействующих с гидроксидом меди (II). Можно ли считать эту реакцию качественной реакцией на много атомные спирты.
Опыт 4. Получение фенолята натрия
В пробирку с 2 мл дистиллированной воды положите 1г фенола и встряхните, оставьте пробирку на некоторое время в штативе. К смеси прибавьте по каплям 10%-ный раствор гидроксида натрия до полного растворения фенола. Запишите в лабораторном журнале уравнение реакции образования фенолята натрия, отметьте изменения в окраске раствора. Содержимое пробирки разделите на две части и добавьте к одной из них раствор 2Н серной кислоты, а к другой – 2Н соляной до помутнения раствора. Вследствие ограниченной растворимости в воде выделившийся фенол образует эмульсию. Запишите наблюдения и уравнения реакций. В выводе сравните кислотность водорода гидроксильных групп спиртов из опыта 3 и фенола. Почему фенол в отличие от алкоголей взаимодействует со щёлочью?
Опыт 5. Бромирование фенола.
Налейте в пробирку 1 мл 3%-ного водного раствора фенола и добавьте к нему 1 мл бромной воды. Содержимое пробирки встряхните. Отметьте появление белых хлопьев трибромфенола. Запишите уравнение реакции, укажите её механизм. В выводе объясните, почему бромирование фенола, в отличие от бромирования бензола, происходит без катализатора.
Типовые задачи
- Напишите все возможные изомеры соединения состава С4Н7ОН.
- К перечисленным веществам: глицерин, бензол, фенол, толуол добавьте два так, чтобы в результате получилось три пары ближайших гомологов. Напишите формулы всех веществ и укажите пары гомологов.
- Напишите уравнение реакции получения гликоля из пентена-2.
- Как можно различить метилпропанол-2 и метилпропанол-1?
- Осуществите превращения:
а) 
б) 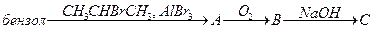
6. Какой объем водяного пара (н.у.) получится при дегидратации 5 кг пентанола-1, если выход реакции составляет 65%?
7. Какой объем кислорода потребуется для полного сгорания 28,75 л этанола и какая масса осадка получится при пропускании продуктов реакции через известковую воду?
Лабораторная работа 12
Альдегиды и кетоны.
Теоретические вопросы
1. Оксосоединения. Особенности строения карбонильной группы.
2. Альдегиды и кетоны. Номенклатура. Изомерия.
3. Способы получения альдегидов и кетонов: окисление первичных и вторичных спиртов, пиролиз солей карбоновых кислот с двухвалентными металлами, гидратация алкинов.
4. Нуклеофильное присоединение к карбонильной группе альдегидов и кетонов: реакции с HCN, гидросульфитом натрия, аммиаком, гидразином, магнийорганическими соединениями.
5. Качественная реакция на альдегиды и кислоты.
6. Восстановление альдегидов и кетонов.
7. Окисление альдегидов: взаимодействие с гидроксидом диамминсеребра и гидроксидом меди (II).
8. Окисление формальдегида.
9. Подвижность атома водорода в a-положении к карбонильной группе.
10. Альдольная и кротоновая конденсация.
11. Получение уротропина.
Экспериментальная часть
Цель работы – изучение химических свойств альдегидов и кетонов.
Опыт 1. Окисление формальдегида и ацетона гидроксидом диамминсеребра
Приготовление реактива Толленса. В чистую пробирку налейте 0,5 мл 1%-го раствора нитрата серебра и 0,5 мл 10%-го раствора гидроксида натрия. К выпавшему бурому осадку гидроксида серебра добавьте по каплям 10%-ный раствор аммиака до полного растворения осадка. Какое соединение серебра образуется в растворе? Запишите уравнения реакций.
Полученный раствор разделите на две пробирки. В одну из них добавьте 1 мл формалина (40%-ный раствор формальдегида в воде), а в другую 1 мл ацетона. Поместите обе пробирки на 5 минут в водяную баню, нагретую до 50оС. В каком случае металлическое серебро осаждается на стенках пробирки в виде блестящего налета (реакция "серебряного зеркала")? Сравните восстановительную активность формальдегида и ацетона. Уравнения реакций наблюдения и вывод запишите в лабораторный журнал.
Опыт 2.Окисление формальдегида и ацетона гидроксидом меди (II)
Приготовьте свежий раствор гидроксида меди (II). Для этого в пробирке смешайте 1 мл 2%-ного раствора сульфата меди (II) и 1 мл 10%-ного раствора гидроксида натрия. Отлейте половину получившегося раствора с осадком гидроксида меди (II) во вторую пробирку. Затем добавьте в 1-ю пробирку 10 капель раствора формалина, а во 2-ю – 10 капель ацетона. Пробирки по очереди осторожно нагрейте в пламени горелки до кипения. В какой из пробирок наблюдается изменение окраски? Чем это объясняется?
| Cu(OH)2 | CuOH | Cu2O | Cu |
| голубой | желтый | красный | «медное зеркало» |
Сравните реакционную способность формальдегида и ацетона. Наблюдения, уравнения реакций и выводы запишите в лабораторный журнал.
О пыт 3. Получение гидросульфитных производных альдегидов и кетонов
а) Взаимодействие бензальдегида с гидросульфитом натрия. В пробирку налейте 1 мл насыщенного раствора гидросульфита натрия и 0,5 мл бензальдегида. Смесь встряхните и охладите под струей холодной воды. Кристаллы поместите на предметное стекло и рассмотрите под микроскопом, зарисуйте их форму под микроскопом. Наблюдения, уравнение реакции запишите в журнал.
б) Взаимодействие ацетона с гидросульфитом натрия. На предметном стекле смешайте стеклянной палочкой 1 каплю насыщенного раствора гидросульфита натрия и 1 каплю ацетона. Образовавшиеся кристаллы рассмотрите под микроскопом, зарисуйте их форму, напишите уравнение реакции. В выводе сравните форму кристаллов в обоих опытах. Отметьте, с какой целью можно применять эту реакцию.
Типовые задачи
1. Приведите формулы двух веществ состава СnH2n-2O2, имеющих одинаковое значение «n» и только по одной альдегидной группе.
2. К перечисленным веществам: триметилфенол, бутаналь, изопропилфенол, этанол, бутанол добавьте одно. В результате должно получится три пары изомеров. Напишите формулы всех веществ и укажите пары изомеров.
3. Приведите примеры синтеза альдегидов из алкена, алкана, алкина. Укажите условия реакций.
4. В пробирке находится смесь гептана, гептанола и гептаналя. Опишите, как можно провести разделение этих веществ.
5. Напишите уравнения реакций взаимодействия любого триметилбутаналя с аммиачным раствором оксида серебра.
6. Напишите уравнения химических реакций взаимодействия: а) бензальдегида с гидроксидом меди (II); б) альдольной конденсации ацетона; в) метилэтилкетона с гидразином; г) пропанона с гидросульфитом натрия; д) кротоновой конденсации пропионового альдегида.
7. Аммиачный раствор оксида серебра обработали избытком формальдегида. По окончании реакции раствор обработали избытком соляной кислоты, при этом выделилось 560 мл газа (н.у.). Вычислите массу оксида серебра, которая была использована для приготовления его аммиачного раствора.
Лабораторная работа 13
Экспериментальная часть
Цель работы – изучение химических свойств карбоновых кислот
Опыт 1. Диссоциация карбоновых кислот.
а)Определение рН растворов карбоновых кислот. В трёх пробирках приготовьте соответственно растворы уксусной, бензойной и щавелевой кислот. Для этого в одну пробирку поместите 0,5 мл 2Н раствора уксусной кислоты и добавьте столько же дистиллированной воды. В другой пробирке растворите несколько кристалликов бензойной кислоты в 1 мл воды. Чтобы ускорить растворение бензойной кислоты, нагрейте пробирку на водяной бане. В третьей - растворите несколько кристалликов щавелевой кислоты в 1 мл воды. Чистой стеклянной палочкой нанесите по капле раствора на кусочки бумаги универсального индикатора на предметном стекле. Сравните цвет полосок индикатора со шкалой, запишите уравнения диссоциации всех кислот, цвет универсального индикатора и значения рН. Растворы кислот оставьте для опыта 1б.
б) Сила карбоновых кислот. К растворам кислот из опыта 1б добавьте по 1 мл насыщенного раствора карбоната натрия. Какие изменения наблюдаете? Запишите уравнения реакций в лабораторный журнал, рассчитайте константы равновесия обменных реакций (Кдис.СН3СООН = 1,75.10-5; Кдис.С6Н5СООН = 1,26.10-5; Кдис.Н2С2О4 = 5,4.10-2; Кдис.НС2О4- = 5,4.10-5; Кдис.Н2СО3 = 4,5.10-7; Кдис.НСОО- = 4,7.10-11). На основании обоих опытов – 1а и 1б –сделайте вывод о силе исследованных электролитов.
Опыт 2. Окисление щавелевой кислоты перманганатом калия. Приготовьте водный раствор щавелевой кислоты как в опыте 1а. Добавьте к нему 2-3 капли 2Н раствора серной кислоты и 1-2 капли 2%-го раствора перманганата калия. Смесь нагрейте на водяной бане. Какой газ выделяется в результате реакции? Запишите наблюдения в лабораторный журнал; в уравнении реакции отметьте окислитель и восстановитель. Объясните, почему необходимо добавлять серную кислоту, сравните величины стандартных электродных потенциалов окислителя в различных средах. Сделайте вывод о восстановительных свойствах щавелевой кислоты.
Опыт 3. Окисление олеиновой кислоты перманганатом калия. К 1 мл олеиновой кислоты (СН3(СН2)7-СН=СН-(СН2)7СООН) прибавьте 1 мл 2%-го раствора перманганата калия. Энергично встряхните содержимое пробирки. Олеиновая кислота окисляется до диоксистеариновой кислоты, а перманганат калия восстанавливается до диоксида марганца. Запишите наблюдения и уравнение реакции. В выводе укажите, класс органических соединений, для которого характерна эта реакция.
Опыт 4. Получение комплексного соединения меди (II) с α-аминопропионовой кислотой .
В коническую колбу налейте 10 мл 2%-го раствора аланина (α-аминопропионовой кислоты) и добавьте к нему 0,5 г CuCO3. Смесь прокипятите. В лабораторном журнале напишите схему образования комплексной соли и отметьте её цвет. В выводе объясните, для каких соединений Сu (II) характерна такая окраска.

Типовые задачи
1. Напишите формулы всех карбоновых кислот состава C5H10O2 .
2. Приведите формулу двух гомологов янтарной кислоты, имеющих а) на 8 электронов больше; б) на 16 электронов меньше.
3. Как можно разделить смесь, содержащую фенол, бензол и уксусную кислоту? Приведите уравнения реакций.
4. Напишите уравнения химических реакций:
а) муравьиной кислоты с аммиачным раствором оксида серебра;
б) линолевой кислоты с бромной водой;
в) кипячения раствора щавелевой кислоты;
г) бензойной кислоты с бромом в присутствии железа;
д) получения хлорангидрида янтарной кислоты.
е) получения полиметилметакрилата из метакриловой кислоты;
5. Напишите уравнения химических реакций:
а) получения полиметилметакрилата из метакриловой кислоты;
б) фталевой кислоты при нагревании;
в) щавелевой кислоты с карбонатом натрия;
г) линолевой кислоты с бромной водой;
д) хлоруксусной кислоты с аммиаком
6. Напишите уравнения химических реакций:
а) стеариновой кислоты с аммиаком;
б) муравьиной кислоты с аммиачным раствором оксида серебра;
в) кипячения растворов щавелевой кислоты;
г) бензойной кислоты с бромом в присутствии железа;
д) получения дипептида a-аминомасляной кислоты
Программа курса «Химия»
Цель изучения курса химии состоит в формировании системных знаний о строении вещества, основных закономерностях протекания химических реакций, закономерностях в химическом поведении основных классов неорганических и органических соединений во взаимосвязи с их строением для использования этих знаний в качестве основы при изучении процессов, протекающих в живом организме, и основных материалов, используемых в стоматологической практике.
Содержание курса
| № | Наименование раздела дисциплины | Содержание раздела |
| 1. | Строение вещества | Корпускулярно-волновой дуализм материального мира. Волновая функция. Электронные конфигурации атомов и ионов. Периодический закон Д.И. Менделеева. Химическая связь. Метод валентных связей. Гибридизация орбиталей. Пространственная конфигурация молекул. Химическая связь в комплексных соединениях. Ионная связь. |
| 2. | Термодинамика и кинетика химических реакций | Основы термохимии. Энтальпия. Закон Гесса. Энтропия. Свободная энергия Гиббса. Условия самопроизвольного протекания реакции. Скорость химической реакции. Порядок реакции. Химическое равновесие. Константа скорости и константа равновесия. Смещение химического равновесия. Понятия адсорбции и катализа. |
| 3. | Химические реакции в растворах | Общие понятия о дисперсных системах. Способы выражения концентрации растворов: массовая доля, титр, молярная, нормальная концентрации. Теория электролитической диссоциации. Зависимость кислотно-основных свойств электролитов от характера их диссоциации. Амфотерные электролиты (амфолиты). Ионные реакции. Условия протекания реакций ионного обмена. |
| 4. | Химические равновесия в растворах | Слабые электролиты. Закон разбавления. Эффект общего иона. Сильные электролиты. Активность и коэффициент активности. Ионная сила. Ионное произведение воды. Водородный показатель. Буферные растворы. Гидролиз солей. Константа гидролиза. Зависимость гидролиза от температуры и концентрации растворов. Константа растворимости. Растворимость. Условия растворения и образования осадка. Электролитическая диссоциация и константа нестойкости комплексных соединений. Коллоидные растворы. |
| 5. | Классы неорганических соединений | Основные классы неорганических соединений. Двойные оксиды. Керамические материалы. |
| 6. | Общие свойства металлов | Общие физические и химические свойства металлов. Сплавы. Сплавы. Микроструктура и диаграммы состояния различных типов сплавов. |
| 7. | Электрохимические процессы | Электрохимические процессы. Возникновение двойного электрического слоя на границе металл-электролит. Электродный потенциал, способы его измерения. Электрохимический ряд напряжений металлов. Принцип работы гальванических элементов. Электрохимическая коррозия. |
| 8. | Введение в органическую химию | Органическая химия как область науки, изучающая строение и механизмы функционирования биологически активных молекул с позиции органической химии. Основные положения теории химического строения. Изомерия. Классы органических соединений. Механизмы органических реакций. |
| 9. | Углеводороды | Предельные и непредельные углеводороды: основные типы химических реакций алканов и алкенов. Сопряженные диены. 1,2- и 1,4-Присоединение к сопряженным диенам. Полимеризация сопряженных диенов. Ароматические соединения. Реакции электрофильного замещения в ароматическом ядре. |
| 10. | Спирты и фенолы | Спирты (алкоголи и алканолы). Атомность спиртов. Водородная связь. Реакционная способность спиртов. Фенол. Кислые свойства фенола. |
| 11. | Карбонилсодержащие органические соединения | Альдегиды и кетоны. Электронное строение карбонильной группы. Реакции оксосоединений по карбонильной группе и по a-положению. Диальдегиды и дикетоны. Ацетилацетон. Кето-енольная таутомерия. |
| 12. | Карбоновые кислоты и их производные | Карбоновые кислоты. Строение карбоксильной группы. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, амиды, нитрилы, сложные эфиры. Методы получения и свойства. Природные высшие жирные кислоты (ВЖК): пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая, арахидоновая. Липиды и фосфолипиды. Ферментативный гидролиз жиров. Окисление кислот в организме. Фрагменты фосфорной кислоты в нуклеиновых кислотах и аденозинфосфатах. Фосфатиды. Лицетин и кефалин. Оксикислоты. Строение и номенклатура оксикислот. Молочная кислота, образование при молочнокислом брожении и в мышцах. Превращение молочной кислоты в пировиноградную при метаболизме. Яблочная, винная и лимонная кислоты. Оптическая изомерия на примерах молочной и винных кислот. |
| 13. | Амины | Амины. Основные свойства аминов. Диамины. Этилендиамин, путресцин, кадаверин, гексаметилендиамин – их биологическое значение и применение. |
| 14. | Аминокислоты | Аминокислоты, входящие в состав белков: классификация, строение, номенклатура, стереоизомерия, кислотно-основные свойства (образование биполярного иона). Химические свойства аминокислот. Биологически важные реакции a-аминокислот: дезаминирование (окислительное и неокислительное), гидроксилирование, декарбоксилирование a-аминокислот (образование коламина, гистамина, триптамина). |
| 15. | Пептиды и белки | Пептиды и белки. Первичная структура белков. Частичный и полный гидролиз. Понятие о сложных белках. Гликопротеиды, липопротеиды, нуклеопротеиды, фосфопротеиды. |
| 16. | Углеводы | Углеводы. Углеводы в природе. Значение углеводов. Фотосинтез. Моносахариды. Цикло-цепная таутомерия. D- и L- ряды. Реакции моноз по функциональным группам. Глюкоза, манноза, галактоза, фруктоза, рибоза и дезоксирибоза; нахождение в природе и биологическое значение. Аскорбиновая кислота. Восстанавливающие и невосстанавливающие дисахариды: сахароза, мальтоза, целлобиоза, лактоза. |
| 17. | Гетероциклические соединения | Биологически важнейшие гетероциклические системы. Нуклеиновые кислоты. Нуклеиновые основания. |
Рейтинговая система оценки знаний студентов по курсу «Химия»:
| Вид работы | Количество работ | Количество баллов | Общая сумма баллов |
| Лабораторные работы | 14 | 2 | 28 |
| Контрольные работы | 10 | 2 | 20 |
| Коллоквиумы | 2 1 | 10 12 | 20 12 |
| Итого за семестр | 80 | ||
| Итоговая аттестация | 20 | ||
| ИТОГО | 100 баллов | ||
| Баллы | Оценки | Оценки ECTS |
| 95 - 100 | 5 | А |
| 86-94 | 5 | В |
| 69-85 | 4 | С |
| 61-68 51-60 | 3 | D |
| 3 | Е | |
| 31-50 0-30 | 2 | FX |
| 2 | F |
Литература
а) основная литература
- Слесарев В.И. Химия. Основы химии живого. Санкт Петербург: Химиздат, 2005 г.
- Глинка Н.Л. Задачи и упражнения по общей химии М.: Высш. шк., 1988.
- Ковальчукова О.В., Авраменко О.В., Ромашкина Е.П., Колядина Н.М. Лабораторные работы по химии. Для студентов I курса медицинского факультета специальности «Стоматология» М.: изд-во РУДН, 2015 г.
- Ковальчукова О.В. Лекции по общей и биоорганической химии. Часть 1. Общая химия. М.: Изд-во РУДН, 2011.
- Ковальчукова О.В., Авраменко О.В. Лекции по общей и биоорганической химии. Часть 2. Биоорганическая химия. М.: Изд-во РУДН, 2010.
б) дополнительная литература
· Хомченко Г.П., Цитович И.К. Неорганическая химия. -М.: Высшая школа, 1986 и др.
· Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия. “Дрофа”, Москва, 2005, 2011.
· Грандберг И.И, Органическая химия. “Дрофа”, Москва, 2002.
ПРИЛОЖЕНИЯ
Таблица 1.
Давление насыщенного водяного пара при различных температурах
| t,0C | h, мм рт ст | t,0C | h, мм рт ст | t,0C | h, мм рт ст |
| 0 | 4,58 | 20 | 17,54 | 35 | 42,18 |
| 10 | 9,21 | 21 | 18,65 | 40 | 55,32 |
| 11 | 9,84 | 22 | 19,83 | 45 | 71,88 |
| 12 | 10,52 | 23 | 21,07 | 50 | 92,51 |
| 13 | 11,23 | 24 | 22,38 | 55 | 118,0 |
| 14 | 11,99 | 25 | 23,76 | 60 | 149,4 |
| 15 | 12,79 | 26 | 25,21 | 65 | 187,5 |
| 16 | 13,63 | 27 | 26,74 | 70 | 233,7 |
| 17 | 14,53 | 28 | 28,35 | 80 | 355,1 |
| 18 | 15,48 | 29 | 30,04 | 90 | 525,8 |
| 19 | 16,48 | 30 | 31,82 | 100 | 760,0 |
Таблица 2.
Константы диссоциации некоторых слабых электролитов
| Электролит | Kдис. | Электролит | Kдис. |
К И С Л О Т Ы
 10-4
10-4
 10-5
10-5
 10-10
10-10
H3PO4
 10-3
10-3
H2B4O7
 10-4
10-4
 10-8
10-8
 10-8
10-8
 10-13
10-13
 10-4
10-4
 10-4
10-4
 10-12
10-12
H2CrO4
 10-1
10-1
 10-2
10-2
 10-7
10-7
H2SO3
 10-2
10-2
 10-2
10-2
 10-8
10-8
 10-10
10-10
H2S
 10-7
10-7
H2C2O4
 10-2
10-2
 10-13
10-13
 10-5
10-5
 10-1
10-1
H2CO3
 10-7
10-7
 10-11
10-11
О С Н О В А Н И Я
 10-9
10-9
 10-5
10-5
 H2O
H2O
 10-5
10-5
 10-7
10-7
 10-1
10-1
 10-5
10-5
 10-4
10-4
Pb(OH)2
 10-4
10-4
Fe(OH)3
 10-11
10-11
 10-8
10-8
 10-12
10-12
 10-10
10-10
 10-2
10-2
 10-9
10-9
Таблица 3.
Произведения растворимости некоторых малорастворимых веществ
| Соединение | Ks | Соединение | Ks |
| AgBr | 4.90  10-13 10-13
| Cu(OH)2 | 2.20  10-20 10-20
|
| AgCl | 1.78  10-10 10-10
| CuI | 1.10  10-12 10-12
|
| AgI | 9.98  10-17 10-17
| CuCO3 | 2.34  10-10 10-10
|
| Ag2SO4 | 5.02  10-5 10-5
| CuS | 6.31  10-36 10-36
|
| Ag2S | 6.31  10-50 10-50
| Cr(OH)3 | 6.31  10-31 10-31
|
| Ag2CrO4 | 1.44  10-12 10-12
| Fe(OH)2 | 7.94  10-16 10-16
|
| Al(OH)3 | 1.10  10-33 10-33
| Fe(OH)3 | 3.72  10-40 10-40
|
| BaCO3 | 5.93  10-9 10-9
| Hg2Cl2 | 1.32  10-18 10-18
|
| BaC2O4 | 1.49  10-7 10-7
| Mg(OH)2 | 1.32  10-11 10-11
|
| BaSO4 | 1.05  10-10 10-10
| Ni(OH)2 | 3.16  10-16 10-16
|
| BaCrO4 | 1.18  10-10 10-10
| PbI2 | 1.34  10-8 10-8
|
| CaCO3 | 3.26  10-9 10-9
| PbCl2 | 6.02  10-5 10-5
|
| CaC2O4 | 2.60  10-9 10-9
| PbSO4 | 1.90  10-8 10-8
|
| CaSO4 | 2.30  10-5 10-5
| PbCrO4 | 1.18  10-14 10-14
|
| CaCrO4 | 3.67  10-3 10-3
| Zn(OH)2 | 1.20  10-17 10-17
|
Таблица 4.
Стандартные окислительно-восстановительные потенциалы некоторых полуреакций
| Элемент | Полуреакция | j0, В |
| Br | Br2 + 2e ® 2Br - | +1.09 |
| BrO3- + 3H2O + 6e ®Br - + 6OH- | +0.61 | |
| HBrO3 + 5H+ + 6e ®Br - + 3H2O | +1.45 | |
| C | 2CO2 + 2H+ ® H2C2O4 | +1.35 |
| Cl | Cl2 + 2e ® 2Cl- | +1.19 |
| ClO4- + 2H+ + 2e®ClO3- +H2O | +0.36 | |
| ClO4- + H2O + 2e ®ClO3- + 2OH- | +1.39 | |
| 2ClO4- + 14H+ + 14e ® Cl2 + 8H2O | +1.47 | |
| 2ClO3- + 12H+ + 10e ® Cl2 + 3H2O | +1.95 | |
| Co | Co3+ + e ® Co2+ | +0.1 |
| [Co(NH3)6]3+ + e® [Co(NH3)6]2+ | ||
| Cr | Cr3+ + 3e ® Cr | -0.74 |
| Cr2O72- + 14H+ + 6e ® 2Cr3+ + 7H2O | +1.33 | |
| CrO42- + 4H2O + 3e ® Cr(OH)3 + 5OH- | -0.13 | |
| Cu | Cu2+ + e ® Cu+ | +0.16 |
| Cu2+ + 2e ® Cu | +0.34 | |
| Cu2+ + I- + e ® CuI | +0.86 | |
| Fe | Fe2+ +2e ® Fe | -0.44 |
| Fe3+ + e ® Fe2+ | +0.77 | |
| Fe3+ + 3e ® Fe | -0.04 | |
| [Fe(CN)6]3- + e ® [Fe(CN)6]4- | +0.36 | |
| H | 2H+ + 2e ® H2 | ±0.00 |
| 2H2O +2e ® H2 +2OH- | -0.83 | |
| I | I2 + 2e ® 2I- ( I3 + 2e ® 3I- ) | +1.78 |
| IO3- + 6H+ + 4e ® HIO + 3H2O | +0.88 | |
| IO3- + 6H+ + 6e ® I- + 3H2O | +0.54 | |
| Mn | MnO4- + 8H+ + 5e ® Mn2+ + 4H2O | +1.51 |
| MnO4- + 2H2O + 3e ® MnO2 + 4OH- | +0.59 | |
| MnO4- + e ® MnO42- | +0.56 | |
| N | NO3- + 4N+ + 3e ® NO + H2O | +0.96 |
| NO3- + 3H+ + 2e ® HNO2 + H2O | +0.94 | |
| NO3- + H2O +2e ® NO2- +2OH- | +0.01 | |
| NO3- + 2H+ + e ® NO2 + H2O | +0.80 | |
| 2NO2 + 8H+ + 8e ® N2 + 4H2O | +1.35 | |
| HNO2 + H+ + e ® NO + H2O | +0.98 | |
| 2HNO2 + 4H+ + 4e ® N2O + 3H2O | +1.29 | |
| 2HNO2 + 6H+ + 6e ® N2 + 4H2O | +1.44 | |
| O | H2O2 + 2H+ +2e ® 2H2O | +1.16 |
| HO2- + H2O + 2e ® 3OH- | +1.08 | |
| O2 + 4H+ + 4e ® 2H2O | +1.23 | |
| O2 + H2O + 4e ® 4OH- | +0.40 | |
| O2 + 2H+ + 2e ® H2O2 | +0.69 | |
| Pb | Pb2+ + 2e ® Pb | -0.13 |
| PbO2 + 4H+ + 2e ® Pb2+ + 2H2O | +1.46 | |
| S | S + 2e ® S2- | -0.48 |
| S + 2H+ + 2e ® H2S | +0.14 | |
| SO42- + 4H+ +2e ® H2SO4 + H2O | +0.17 | |
| SO42- + 8H+ + 6e ® S + 4H2O | +0.36 | |
| SO42- + H2O + 2e ® SO32- + 2OH- | -0.93 | |
| SO42- + 10H+ + 8e ® H2S + 4H2O | +0.30 | |
| S2O82- + 2e ® 2SO42- | +2.01 | |
| S4O62- + 2e ® 2S2O32- | +0.22 | |
| H2SO3 + 4H+ + 4e ® S + 3H2O | +0.45 | |
| Sn | Sn4+ + 2e ® Sn2+ | +0.15 |
Таблица 5.
Константы нестойкости некоторых комплексных ионов
| Ион | Комплексный ион | Kнест. | Ион | Комплексный ион | Kнест. |
| Ag+ | [Ag(NH3)2]+ | 6.1  10-8 10-8
| Cu2+ | CuCl42- | 6.60  10-6 10-6
|
| [Ag(SCN)4]3- | 6.6  10-12 10-12
| [Cu(NH3)4]2+ | 9.35  10-13 10-13
| ||
| [Ag(S2O3)3]5- | 7.1  10-15 10-15
| [Cu(SCN)4]2- | 3.02  10-7 10-7
| ||
| [Ag(CN)4]3- | 3.8  10-20 10-20
| [Cu(S2O3)3]5- | 1.45  10-14 10-14
| ||
| [Ag(EDTA)]3- | 4.7  10-8 10-8
| [Cu(EDTA)]2- | 1.58  10-19 10-19
| ||
| Al3+ | [Al(OH)4] - | 1.00  10-33 10-33
| Fe2+ | [Fe(CN)6]4- | 1.00  10-24 10-24
|
| [AlF6]3- | 2.1  10-21 10-21
| [Fe(EDTA)]2- | 4.67  10-15 10-15
| ||
| [Al(EDTA)] - | 7.4  10-17 10-17
| Fe3+ | [Fe(SCN)6]3- | 5.88  10-4 10-4
| |
| Ba2+ | [Ba(EDTA)]2- | 1.6  10-8 10-8
| [FeF6]3- | 7.94  10-17 10-17
| |
| Ca2+ | [Ca(EDTA)]2- | 2.69  10-11 10-11
| [Fe(CN)6]3- | 1.00  10-31 10-31
| |
| Co2+ | [Co(NH3)6]2+ | 4.08  10-5 10-5
| [Fe(EDTA)] - | 7.94  10-26 10-26
| |
| [Co(SCN)4]2- | 6.29  10-3 10-3
| Mg2+ | [Mg(EDTA)]2- | 2.04  10-9 10-9
| |
| [Co(EDTA)]2- | 6.17  10-17 10-17
| Mn2+ | [Mn(EDTA)]2- | 9.09  10-15 10-15
| |
| Co3+ | [Co(NH3)6]3+ | 2.19  10-34 10-34
| Pb2+ | [Pb(OH)3]- | 5.00  10-12 10-12
|
| [Co(NO2)6]3- | 1.00  10-22 10-22
| [Pb(EDTA)]2- | 9.09  10-19 10-19
| ||
| [Co(EDTA)]- | 1.00  10-36 10-36
| Sn2+ | [Sn(OH)3] - | 7.41  10-26 10-26
| |
| Cr3+ | [Cr(OH)4]- | 1.26  10-30 10-30
| [SnCl4]2- | 3.31  10-2 10-2
| |
| [Cr(SCN)6]3- | 1.59  10-4 10-4
| Zn2+ | [Zn(NH3)4]2+ | 3.98  10-10 10-10
| |
| [Cr(EDTA)]- | 1.00  10-24 10-24
| [Zn(OH)4]2- | 2.19  10-15 10-15
| ||
| [Zn(EDTA)]2- | 3.16  10-17 10-17
|
Таблица 6.
Плотности растворов соляной кислоты различных концентраций
| r, г / мл | w, % | r, г / мл | w, % | r, г / мл | w, % |
| 1,010 | 2,14 | 1,065 | 13,19 | 1,120 | 23,82 |
| 1,015 | 3,12 | 1,070 | 14,17 | 1,125 | 24,78 |
| 1,020 | 4,13 | 1,075 | 15,16 | 1,130 | 25,75 |
| 1,025 | 5,15 | 1,080 | 16,15 | 1,135 | 26,70 |
| 1,030 | 6,15 | 1,085 | 17,13 | 1,140 | 27,66 |
| 1,035 | 7,15 | 1,090 | 18,11 | 1,145 | 28,61 |
| 1,040 | 8,16 | 1,095 | 19,06 | 1,150 | 29,57 |
| 1,045 | 9,16 | 1,100 | 20,01 | 1,160 | 31,52 |
| 1,050 | 10,17 | 1,105 | 20,97 | 1,165 | 32,49 |
| 1,055 | 11,19 | 1,110 | 21,92 | 1,175 | 34,42 |
| 1,060 | 12,18 | 1,115 | 22,86 | 1,200 | 39,11 |
Пример интерполяции
Пусть требуется найти массовую долю (wх) раствора соляной кислоты плотностью rх = 1,142 г/мл. В табл. 6 такого значения плотности нет, но есть близкие к нему значения:
rmin = 1,140 г/мл wmin = 27,66 %
rmax = 1,145 г/мл wmax = 28,61 %
Значение wх, соответствующее плотности rх = 1,142 г/мл, можно рассчитать по следующей формуле:
wх = wmin + 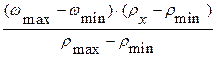 =
=
= 27,66 % + 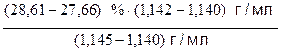 = 28,04%
= 28,04%
Таблица 7.
Растворимость некоторых оснований и кислот в воде
| NH4+ | Na+ | K+ | Mg2+ | Ca2+ | Ba2+ | Al3+ | Cr3+ | Zn2+ | Mn2+ | |
OH 
| р | р | р | м | м | р | н | н | н | н |
F 
| р | р | р | н | н | м | м | н | м | м |
Cl 
| р | р | р | р | р | р | р | р | р | р |
Br 
| р | р | р | р | р | р | р | р | р | р |
I 
| р | р | р | р | р | р | р | р | р | р |
S2 
| р | р | р | р | м | р | - | - | н | н |
SO32 
| р | р | р | н | н | н | - | - | н | н |
SO42 
| р | р | р | р | м | н | р | р | р | р |
NO3 
| р | р | р | р | р | р | р | р | р | р |
PO43 
| р | р | р | н | н | н | н | н | н | н |
CO32 
| р | р | р | н | н | н | - | - | н | н |
SiO32 
| - | р | р | н | н | н | н | н | р | н |
CH3COO 
| р | р | р | р | р | р | м | р | р | р |
| Co2+ | Ni2+ | Fe2+ | Fe3+ | Cd2+ | Hg2+ | Cu2+ | Ag+ | Sn2+ | Pb2+ | |
OH 
| н | н | н | н | н | - | н | - | н | н |
F 
| р | р | н | н | р | - | н | р | р | н |
Cl 
| р | р | р | р | р | р | р | н | р | м |
Br 
| р | р | р | р | р | м | р | н | р | м |
I 
| р | р | р | р | р | н | р | н | р | н |
S2 
| н | н | н | - | н | н | н | н | н | н |
SO32 
| н | н | н | - | н | н | н | н | - | н |
SO42 
| р | р | р | р | р | р | р | м | р | р |
NO3 
| р | р | р | р | р | р | р | р | - | р |
PO43 
| н | н | н | н | н | н | н | н | н | н |
CO32 
| н | н | н | н | н | н | н | н | - | н |
SiO32 
| н | н | н | н | н | - | н | н | - | н |
CH3COO 
| р | р | р | р | р | р | р | р | р | р |
р - растворимое вещество (растворимость свыше 1 г в 100 г воды); м - малорастворимое вещество (растворимость от 0,1 до 1 г в 100 г воды); н - практически не растворимое вещество (растворимость меньше 0,1 г в 100 г воды); прочерк означает, что вещество не существует или разлагается водой.
СОДЕРЖАНИЕ
Стр.
| РЕКОМЕНДАЦИИ К ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ........................................... | 3 |
| Семинар 1 Основные классы неорганических соединений…………………………………………………. | 6 |
| Лабораторная работа 1 Скорость химической реакции. Химическое равновесие........................................................ | 7 |
| Лабораторная работа 2 . Приготовление раствора соляной кислоты……………………………………….. | 16 |
| Лабораторная работа 3 . Стандартизация раствора соляной кислоты………………………………………. | 22 |
| Семинар 2 . Строение атома. Периодический закон Д.И.Менделеева. Химическая связь…................................ | 27 |
| Лабораторная работа 4 . Ионные и гетерогенные равновесия в растворах.………………………........ | 29 |
| Лабораторная работа 5 . рН растворов. Гидролиз солей…………………........................................................ | 39 |
| Лабораторная работа 6 . Буферные растворы……………………………………………….. | 47 |
| Лабораторная работа 7 . Коллоидные растворы …… | 52 |
| Лабораторная работа 8 . Комплексные соединения… | 61 |
| Лабораторная работа 9 . Окислительно-восстановительные реакции........................................... | 67 |
| Семинар 3 Гальванические элементы. Коррозия металлов и сплавов………………………………………. | 76 |
| Семинар 4 Изомерия органических соединений……….. | 78 |
| Лабораторная работа 10 . Химические свойства углеводородов………………………………………….. | 80 |
| Лабораторная работа 11 . Спирты и фенолы……………………………………………………. | 87 |
| Лабораторная работа 12.Альдегиды и кетоны……….. | 92 |
| Лабораторная работа 13 . Карбоновые кислоты. Аминокислоты……………………………………….. | 96 |
| ПРОГРАММА КУРСА……………………………………. | 102 |
| ПРИЛОЖЕНИЯ………………………………………… | 110 |
Основные классы неорганических соединений
1. Основные классы соединений: оксиды (несолеобразующие, кислотные, амфотерные, основные), гидроксиды (основания и кислоты, их получение из оксидов), соли.
2. Назовите вещества и определите к каким классам соединений они относятся: Р2О3, СО, СО2, NaOH, CuS, Fe(OH)3, Pb(OH)2, CH3COOH, H2SO4, Ca(HCO3)2, PbO2, FeO, NaCl. Приведите примеры реакций получения и свойств этих соединений.
3. Осуществите следующие превращения:
1) Fe ® FeCl2 ® Fe(OH)2 ® Fe(OH)3 ® Fe2O3
2) CO2 ® CaCO3 ® Ca(HCO3)2 ® CaCO3 ® CO2
3) Na®NaOH®NaHCO3®Na2CO3 ®Na2SO4 ®NaCl®Na
4) Al ® AlCl3 ® Na3[Al(OH)6] ®Al(NO3)3 ® Al
5) S ® SO2 ® Na2SO3 ® NaHSO3 ® Na2SO3 ® Na2SO4
6) N2 ® NH3 ® NO ® NO2 ® HNO3 ® NH4NO3
7) CO2®C ®CO®CO2®CaCO3®Ca(HCO3)2®CO2
Лабораторная работа 1
Скорость химической реакции. Химическое равновесие
Теоретические основы . Скорость химической реакции можно рассматривать как изменение количеств реагирующих или образующихся в процессе реакции веществ за единицу времени. Если реакция проходит при постоянном объеме, то ее скорость можно описать как изменение молярных концентраций веществ в единицу времени.
v = 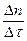 =
= 
Скорость химической реакции зависит от различных факторов: природы реагирующих веществ, их концентрации, степени измельчения (для гетерогенных реакций), температуры реакционной смеси, присутствия катализаторов.
Зависимость скорости реакции от концентрации реагирующих веществ. Скорость химической реакции пропорциональна концентрациям реагирующих веществ (закон действия масс). Для простой одностадийной реакции
а А + b B  с С
с С
v = k C 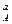 C
C  ,
,
где k - константа скорости реакции, определяющая скорость реакции при концентрациях реагирующих веществ, равных 1 моль/л. Константа скорости зависит от природы реагирующих веществ и от температуры.
СА, СВ - концентрации газообразных или растворенных веществ (концентрации твердых и жидких реагентов - постоянные величины, их значения включены в величину константы скорости реакции и отдельно не записываются).
Зависимость скорости реакции от температуры. При увеличении температуры на 10° скорость реакции увеличивается в 2-4 раза (правило Вант Гоффа).
v2 = v1 g  ,
,
где v2 и v1 - скорости реакции при температурах t2 и t1;
g - температурный коэффициент скорости, определяет изменение скорости реакции при изменении температуры на 10°.
Химическое равновесие. Если химическая реакция может протекать только в одном направлении, то она называется необратимой. Реакции, протекающие одновременно в двух направлениях, обратимы. С течением времени скорость прямой реакции (v 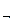 ) уменьшается, а скорость обратной реакции (v
) уменьшается, а скорость обратной реакции (v 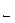 ) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
) увеличивается до тех пор, пока они не становятся равными. В системе устанавливается химическое равновесие. Условие химического равновесия:
v 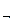 = v
= v 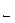 .
.
Состояние химического равновесия описывается константой равновесия, К. Для обратимой химической реакции
a A + b B 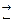 c C + d D
c C + d D
K = 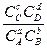 , где
, где
CA, CB, CC, CD - концентрации газообразных или растворенных веществ.
Состояние химического равновесия - динамическое. Его можно смещать. Смещение химического равновесия подчиняется принципу Ле Шателье (принципу противодействия): еcли на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие (изменяются температура, давление, концентрация одного из исходных веществ или продуктов реакции), то положение равновесия смещается в ту сторону, которая ослабляет внешнее воздействие.
Увеличение температуры вызывает смещение равновесия в сторону протекания эндотермической реакции (DH>0), а уменьшение температуры - в сторону экзотермической реакции (DH<0).
Увеличение давления в системе вызывает смещение равновесия в сторону меньшего количества газообразных веществ, а уменьшение давления - в сторону большего количества газообразных веществ.
Увеличение концентрации одного из исходных веществ вызывает смещение равновесия реакции вправо (в сторону его расходования, то есть в сторону образования продуктов реакции), а увеличение концентрации одного из продуктов реакции - влево.
Цель работы. Экспериментальное подтверждение закона действия масс (установление зависимости скорости реакции от концентрации реагирующих веществ) и принципа Ле Шателье.
Порядок работы.
Опыт 1.Зависимость скорости реакции от концентрации реагирующих веществ.
В качестве экспериментальной реакции берется реакция взаимодействия тиосульфата натрия Na2S2O3 c cерной кислотой:
Na2S2O3 +H2SO4 = Na2SO4 + S + H2O + SO2
В процессе реакции сначала образуется коллоидный раствор серы, с течением времени наблюдается опалесценция, а затем и полное помутнение реакционной смеси. Временем, за которое протекает реакция, принимаем время, проходящее от момента сливания двух растворов до заметного помутнения смеси.
1. В три пронумерованных химических стакана налейте из бюретки 0,1М раствор тиосульфата натрия: в первый - 10 мл, во второй - 20 мл и в третий - 30 мл. Затем в первый и во второй стаканы долейте дистиллированной воды - 20 и 10 мл соответственно, так, чтобы объем в каждом стакане составил 30 мл. (Таким образом, условная концентрация в стаканах составит: №1 - С, в №2 - 2С, в №3 - 3С).
2. В стакан №1 добавьте 10 мл серной кислоты из цилиндра, перемешайте стеклянной палочкой и включите секундомер. Определите время в секундах от момента слияния растворов до помутнения раствора. Результаты занесите в таблицу.
3. Повторите опыты с растворами в стаканах №2 и №3.
Опыт 2. Смещение химического равновесия
Смещение химического равновесия вследствие изменения равновесных концентраций реагирующих веществ изучается на примере обратимой реакции между хлоридом железа(III) и роданидом калия или аммония. В результате реакции образуется соединение - роданид железа(III) - раствор кроваво-красного цвета:
FeCl3 + 3KSCN D Fe(SCN)3 + 3KCl
Интенсивность окраски реакционной смеси зависит от концентрации Fe(SCN)3. Наблюдая за изменением окраски смеси при изменении концентрации реагирующих веществ, можно судить о направлении смещения химического равновесия в изучаемой системе.
1. В стакане смешать по 10 мл 0,5 н растворов FeCl3 и KSCN.
2. Реакционную смесь, равновесие в которой устанавливается практически мгновенно, разлить в четыре пробирки. Первая пробирка является контрольной, для сравнения.
3. Во вторую пробирку добавить 2-3 капли насыщенного раствора FeCl3.
4. В третью пробирку добавить 2-3 капли насыщенного раствора KSCN.
5. В четвертую пробирку добавить несколько кристалликов KCl и раствор перемешать.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. К опыту 1. Экспериментальные данные занесите в таблицу:
| № стакана | Объем Na2S2O3 V1 (мл) | Объем воды V2 (мл) | Объем H2SO4 V3 (мл) | Время реакции t (сек) | Относит. скорость 1/t |
| 1 2 3 |
Расчеты и задания:
а) Рассчитайте условную скорость протекания реакции для каждого опыта по формуле:
Vусл = 1/ t, где t - время реакции в секундах.
б) Постройте график зависимости скорости реакции от концентрации реагирующих веществ, где на оси абсцисс отложите условную концентрацию раствора, а на оси ординат - условную скорость реакции.
в) Проанализируйте график и сделайте вывод о зависимости скорости реакции от концентрации одного из реагентов.
4. К опыту 2. Экспериментальные данные занесите в таблицу:
| Пробирка
| ||||
| 1 | 2 | 3 | 4 | |
| 1. Цвет раствора до опыта | ||||
| 2. Какое вещество добавили | ||||
| 3. Цвет раствора после добавления вещества | ||||
| 4. Направление смещения равновесия | ||||
Расчеты и задания:
Перепишите уравнение изучаемой реакции и на основе принципа Ле Шателье объясните направление смещения равновесия в реакционной смеси в пробирках 2-4.
Типовые задачи
1. Напишите математическое выражение скоростей следующих реакций:
а) N2 + O2  б) С + О2
б) С + О2  в) FeO + H2
в) FeO + H2 
2. Напишите выражение константы равновесия химической реакции: 2А + В  3С + 2D.
3С + 2D.
3. Найти значение константы скорости реакции А + В ® АВ, если при концентрациях веществ А и В, равных соответственно 0,05 и 0,01 моль/л, скорость реакции равна 5,0×10-5 моль / л×мин ?
4. Как изменится скорость реакции 2СО + О2 ® 2СО2, если повысить концентрацию СО в 3 раза, а концентрацию О2 – в 2 раза?
5. Во сколько раз изменится скорость реакции 2А + В ® А2В, если концентрацию вещества А увеличить в 3 раза, а концентрацию вещества В уменьшить в 3 раза?
6. Как изменится скорость реакции 2NO + O2 ® 2NO2, если уменьшить давление в системе в 3 раза?
7. Во сколько раз в системе 2А2 + В2 ® 2А2В надо увеличить концентрацию вещества В2, чтобы при уменьшении концентрации вещества А2 в 4 раза скорость прямой реакции не изменилась?
8. Во сколько раз возрастет скорость реакции при повышении температуры от 10 до 500С, если температурный коэффициент ее скорости равен 2?
9. При повышении температуры от 20 до 500С скорость некоторой реакции возросла в 27 раз. Найти температурный коэффициент скорости данной реакции.
10. При 1500С некоторая химическая реакция заканчивается за 16 мин. За какое время эта реакция закончится при 1800С, если температурный коэффициент ее скорости равен 2?
11. При 1500С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости данной реакции равным 2, рассчитать, через какое время она закончится при 1700С.
12. В каком направлении сместится равновесие в системе Н2О + СО  СО2 + Н2 при добавлении паров воды?
СО2 + Н2 при добавлении паров воды?
13. В каком направлении сместится равновесие в системе Ag+ + Cl- 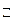 AgCl при добавлении хлорида натрия?
AgCl при добавлении хлорида натрия?
14. В каком направлении сместится равновесие в системе 2СО (г) + О2(г) 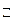 2СО2, DН0 = – 566 кДж а) при повышении давления; б) при понижении температуры?
2СО2, DН0 = – 566 кДж а) при повышении давления; б) при понижении температуры?
Лабораторная работа 2
Приготовление раствора соляной кислоты
Теоретические основы . Растворы - это гомогенные системы переменного состава. Они состоят из растворителя и растворенного вещества, соотношение между которыми определяется концентрацией раствора.
Способы выражения концентрации раствора:
а) массовая доля раствора (процентная концентрация) показывает массу растворенного вещества в 100 г раствора
 w =
w = 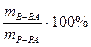
(например, 3%-ный раствор NaOH, раствор NaOH с w=3% или w =0,03);
б) молярная концентрация раствора (молярность) показывает количество растворенного вещества в 1 л раствора
 СМ =
СМ = 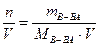
(например 2 М раствор HCl или раствор HСl с СМ = 2 моль/л);
в) молярная концентрация эквивалента (нормальная концентрация или нормальность) показывает количество эквивалентов вещества в 1 л раствора
 Cн =
Cн = 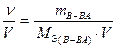
(например, 0,1н раствор НNO3 или раствор НNO3 c Cн =0,1 моль/л).
Цель работы. По плотности исходного раствора соляной кислоты, экспериментально определенной с помощью ареометра, найти по таблице его концентрацию. Рассчитать объем концентрированного раствора соляной кислоты и воды, необходимые для приготовления требуемого объема кислоты заданной концентрации. Приготовить раствор кислоты.
Порядок работы.
1. Налейте исходный раствор кислоты в цилиндр без делений примерно на половину его объема.
2. Осмотрите ареометры. Ареометр, рассчитанный на измерение меньших плотностей, опустите в раствор кислоты в мерном цилиндре. Если шкала ареометра полностью находится над поверхностью, замените его на другой - для измерения больших плотностей. Для снятия показаний на шкалу смотрят несколько снизу, сквозь толщу раствора. Верхняя видимая при этом метка соответствует плотности раствора (r).
3. В таблице зависимости плотности раствора от концентрации найдите массовую долю раствора соляной кислоты. При необходимости проведите интерполяцию.
4. Рассчитайте объемы исходного раствора Vисх и дистиллированной воды, необходимые для приготовления 250 мл 0,1 н раствора соляной кислоты.
5. Мерным цилиндром объемом 10 мл отмерьте в склянку рассчитанный объем исходного раствора НCl и мерным цилиндром объемом 250 мл - рассчитанный объем дистиллированной воды.
6. Закройте склянку пробкой и перемешайте содержимое, опрокидывая склянку не менее 20 раз.
7. На листе бумаги запишите: “HCl  0,1н”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
0,1н”, свою фамилию, номер группы, закрепите его на склянке и оставьте раствор кислоты до следующего занятия.
Форма лабораторного отчета.
1. Название лабораторной работы.
2. Краткое описание, цель работы.
3. Задание: приготовить 250 мл 0,1 н раствора соляной кислоты. Образец концентрированной кислоты № ..... .
4. Характеристика исходного раствора соляной кислоты:
плотность r = .......
интерполяция: ........
массовая доля исходного раствора кислоты w = ...... .
5. Расчеты:
а) масса соляной кислоты, содержащаяся в 250 мл 0,1 N раствора соляной кислоты
mHCl = MЭ (HCl)  Cн
Cн  Vр-ра = .......
Vр-ра = .......
б) масса исходного раствора соляной кислоты, содержащая рассчитанное количество соляной кислоты
mисх .р-ра = 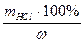 = ......
= ......
в) объем исходного раствора соляной кислоты
Vисх.р-ра = mисх. р-ра / r = ......
г) объем дистиллированной воды
Vводы = 250 - Vисх .р-ра
Типовые задачи и вопросы.
1. Почему, измеряя плотность жидкости, надо сначала использовать ареометр для измерения меньших плотностей?
2. На каком законе основано действие ареометра?
3. Какая масса серной кислоты содержится в 400 мл 0,2 N раствора?
4. Пользуясь данными таблицы зависимости плотности от массовой доли раствора и применив метод интерполяции, рассчитайте массовую долю раствора соляной кислоты с плотностью 1,163 г/мл.
5. В 600 г воды растворили 40 г хлорида калия. Вычислите массовую долю (%) хлорида калия в полученном растворе.
6. Сколько граммов воды содержится в 500 г 20% раствора бромида калия?
7. Определите массовую долю (%) СuSO4 в растворе, полученном при растворении 50 г медного купороса СuSO4·5Н2О в 450 г воды.
8. Найти массовую долю (%) азотной кислоты в растворе, в 1 л которого содержится 224 г HNO3 (r=1,12г/мл).
9. Из 400 г 50% (по массе) раствора H2SO4 выпариванием удалили 100 г воды. Чему равна массовая доля (%) H2SO4 в оставшемся растворе.
10. Найти массу (г) NaNO3, необходимую для приготовления 300 мл 0,2 М раствора.
11. Сколько граммов гидроксида калия нужно взять для приготовления 500 мл 2 Н раствора?
12. Какой объем (мл) 96 % серной кислоты (r=1,84 г/мл) надо взять для приготовления 1,2 л 0,5 М раствора?
13. Какой объем (мл) 2 М раствора Na2СO3 надо взять для приготовления 1 л 0,25 Н раствора?
14. Какой объем (л) 2н раствора H2SO4 потребуется для приготовления 500 мл 0,5 Н раствора?
Лабораторная работа 3
Дата: 2019-02-02, просмотров: 384.