K4[Mo(CN)8] = 4 К + + [Mo(CN)8 ]4-.
Заряд комплексного иона [ Mo ( CN )8]4- равен суммарному заряду ионов внешней сферы, но противоположен ему по знаку.
Вторичная диссоциация комплексного иона обратима и протекает по типу диссоциации слабого электролита:
[ Mo ( CN )8]4- <=> Мох + 8 CN - .
Степень окисления комплексообразователя (х) определяется п о заряду комплексного иона:
х
[ Mo ( CN )8] 4-.
х + 8·(–1) = –4, откуда х = + 4, т.е. заряд комплексообразователя Мо4+.
Координационное число комплексообразователя (Мо4+) равно суммарному числу лигандов ( CN - ), окружающих комплексообразователь, т.е. 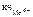 = 8.
= 8.
Так как соединение [ PtCl 4 ( NH 3 )2] не содержит внешней сферы, то его заряд равен нулю (неэлектролит) и для него наблюдается только вторичная диссоциация:
[Pt(NH3)2Cl4]0 <=> Р tx + 2NH 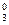 + 4Cl-.
+ 4Cl-.
x + 2 · 0 + 4 · (–1) = 0, x = +4,
т.е. заряд комплексообразователя Р t 4+ , а 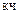 Pt 4+ = 6.
Pt 4+ = 6.
Ответ: [ Mo ( CN )8]4-, [ PtCl 4 ( NH 3 )2]0; Мо4+, Pt 4+ ; 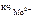 = 8;
= 8; 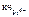 = 6.
= 6.
2. Константы нестойкости комплексных ионов [ Fe ( CN )6]4- и [ Fe ( CN )6]3- соответственно равны 1·10-37 и 1·10-44. Написать выражения констант нестойкости этих ионов и рассчитать константы их устойчивости. Какой из комплексных ионов является более прочным?
| Дано : [Fe(CN)6]4- [Fe(CN)6]3- |
Решение Диссоциация комплексных ионов – процесс обратимый и количественно характеризуется константами нестойкости. [ Fe ( CN )6]4- <=> Fe2+ + 6CN- ; |
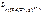 – ? – ?
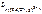 – ? – ?
|
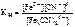 = 1·10-24;
= 1·10-24;
[ Fe ( CN )6]3- <=> Fe 3+ + 6 CN - ;
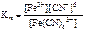 = 1·10-3.
= 1·10-3.
Константы устойчивости – константы равновесия обратных процессов (образования комплексных ионов).
Fe2+ + 6CN- <=> [Fe(CN)6]4-;
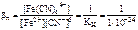 = 1024;
= 1024;
Fe3+ + 6CN- <=> [Fe(CN)6]3-;
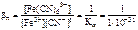 = 1031.
= 1031.
Значение константы устойчивости комплексного иона [ Fe ( CN )6]3- больше константы устойчивости комплексного иона [ Fe ( CN )6]4-. Значит, комплексный ион [ Fe ( CN )6]3- более прочный.
Ответ: комплексный ион [ Fe ( CN )6]3- более прочный.
3. Составить формулы следующих комплексных соединений с координационным числом платины ( IV ), равном шести: Pt C l 4 ·6 NH 3 ; PtCl 4 ·4 NH 3 ; PtCl 4 ·2 NH 3 . Написать уравнения диссоциации этих солей в водном растворе и назвать их.
| Дано: PtCl 4 ·6 NH 3 PtCl 4 ·4 NH 3 PtCl 4 ·2 NH 3 |
Решение В состав внутренней сферы Включается шесть лигандов. В первую очередь – молекулы аммиака и затем до Координационного числа шесть – ионы хлора. Остальные ионы хлора образуют внешнюю сферу. |
| Комплексные соединения – ? |
PtCl4·6NH3 → [Pt(NH3)6]Cl4 = [Pt(NH3)6]4+ + 4Cl-;
[Pt(NH3)6]4+ <=> Pt4+ + 6NH3 ;
PtCl4·4NH3 → [Pt(NH3)4Cl2]Cl2 = [Pt(NH3)4Cl2]2+ + 2Cl- ;
[Pt(NH3)4Cl2]2+ <=> Pt4+ + 4NH3 + 2Cl-;
PtCl4 ·2NH3 → [Pt(NH3)2Cl4] <=> Pt4+ + 2NH3 + 4Cl- ;
[Pt(NH3)6]Cl4 – хлорид гексаамминплатины (IV);
[Pt(NH3)4Cl2]Cl2 – хлорид дихлоротетраамминплатины (IV);
[ Pt ( NH 3 )2 Cl 4 ] – тетрахлородиамминплатина
Дано:
 = 200 л
Ж = 9 ммоль/л = 200 л
Ж = 9 ммоль/л
|
Решение Ж = |
 – ? – ?
|
Дано:
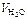 = 2,5 м3
Жобщ = 13,6 ммоль/л = 2,5 м3
Жобщ = 13,6 ммоль/л
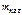 = 1 кг = 1 кг
|
Решение Обменная емкость катионита (ε) – максимальное количество ионов (ммоль), поглощаемое 1 г катионита обменным путем (ммоль/г). |
| ε – ? |
ЖЕСТКОСТЬ ВОДЫ
УРОВЕНЬ В
Вычислить жесткость воды, если в 140 л воды содержится 16,2 г ионов кальция и 2,92 г ионов магния.
Дано:
 = 16,2 г = 16,2 г
 = 140 л = 140 л
 = 2,92 г = 2,92 г
|
Решение
Ж = 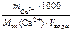 +
+ 
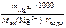 ;
;
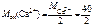 = 20 г/моль (мг/ммоль)
= 20 г/моль (мг/ммоль)
 =12 г/моль (мг/ммоль).
=12 г/моль (мг/ммоль).
Перевод моль в миллимоль.
Ж =  =7,53 ммоль/л.
=7,53 ммоль/л.
Ответ: Ж = 7,53 ммоль/л.
Дата: 2018-12-28, просмотров: 351.
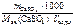 ,
,