ИОННО-МОЛЕКУЛЯРНЫЕ УРАВНЕНИЯ
УРОВЕНЬ В
1. Вычислить рН следующих водных растворов:
а) 0,02 М HCl ,
б) 0,2 М KOH .
| Дано: c HCl = 0,02 М c KOH = 0,2 М |
Решение
а) HCl = H + + Cl -
рН = - lg c 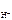 ;
;
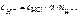
HCl – сильный электролит, α = 1,
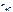 – число Н+, образовавшихся при диссоциации одной молекулы НС l ,
– число Н+, образовавшихся при диссоциации одной молекулы НС l ,
n 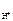 = 1, тогда
= 1, тогда 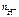 = c
= c 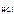 = 0,02 моль/л = 2 · 10-2 моль/л.
= 0,02 моль/л = 2 · 10-2 моль/л.
рН = - lg 2·10-2 = - lg 2 + (- lg 10-2)= – 0,3 + 2 = 1,7.
б) KOH = К+ + ОН-;
рН = 14 – рОН; рОН = - lgc 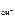 ,
,
c 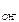 = c
= c 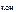 · α · n
· α · n 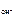 ,
,
КОН – сильный электролит, α = 1,
n 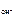 – число ОН-, образовавшихся при диссоциации одной молекулы КОН, n
– число ОН-, образовавшихся при диссоциации одной молекулы КОН, n  = 1, тогда c
= 1, тогда c  = c KOH = 2·10-1 моль/л,
= c KOH = 2·10-1 моль/л,
рОН = – lg (2·10-1) = – lg 2 + (– lg 10-1) = – 0,3 + 1 = 0,7.
рН = 14 – 0,7 = 13,3.
Ответ: рН 0,02 М HCl равно 1,7;
рН 0,2 М КОН равно 13,3.
Вычислить рН 0,05 М водного раствора хлорноватистой кислоты ( HOCl ).
Дано:
c  = 0,05 М = 0,05 М
|
Решение
HOCl <=> H + + OCl -
HOCl – слабый электролит.
рН = – lg [ H + ]; [ H + ] = c Н O С l ·α· n 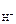 ,
,
n 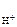 – число Н+ образовавшихся при диссоциации одной молекулы HOCl , n
– число Н+ образовавшихся при диссоциации одной молекулы HOCl , n 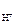 = 1.
= 1.
 ;
;
К HOCl – константа диссоциации H O Cl :
К 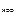 = 5,0·10-8 (таблица),
= 5,0·10-8 (таблица),
Тогда
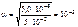
c 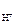 = 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
= 5·10-2 · 10-3 · 1 = 5,0 · 10-5 моль/л,
тогда рН = – lg 5,0·10-5 = (- lg 5) + (- lg 10-5) = – 0,7 + 5 = 4,3.
Ответ: рН 0,05 М HOCl равно 4,3.
3. Определить произведение растворимости MgF 2 , если его растворимость в воде при 25 ºС равна 1,17·10-3 моль/л.
Дано:
c 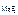 = 1,17·10-3 моль/л = 1,17·10-3 моль/л
|
Решение
Равновесие между осадком малорастворимого электролита и насыщенным раствором над ним выражается уравнением
 – ?
– ?
MgF 2(к) <=> Mg 2+ (р) + 2 F - (р) ,
ПР 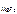 = [ Mg 2+ ]·[ F - ]2,
= [ Mg 2+ ]·[ F - ]2,
[ Mg 2+ ] = c 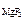 ·α· n
·α· n 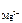 , [ F - ] = c
, [ F - ] = c 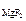 ·α· n
·α· n 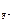 .
.
MgF 2 – сильный электролит, α = 1;
n 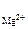 = 1, n
= 1, n  = 2 (из приведенного уравнения)
= 2 (из приведенного уравнения)
[ Mg 2+ ] = 1,17·10-3·1·1 = 1,17·10-3 моль/л;
[ F - ] = 1,17·10-3·1·2 = 2,34·10-3 моль/л.
Тогда ПР 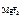 = 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
= 1,17·10-3·(2,34 · 10-3)2 = 6,41·10-9.
Ответ: ПР  = 6,41·10-9.
= 6,41·10-9.
8. ГИДРОЛИЗ СОЛЕЙ
УРОВЕНЬ B
1. Написать ионно-молекулярные и молекулярные уравнения гидролиза солей:
а) сульфата хрома ( III ),
б) сульфида натрия
И указать реакцию среды их водных растворов.
| Дано: а) сульфат хрома ( III ) б) сульфид натрия |
Решение
а) Cr 2 ( SO 4 )3 диссоциирует в водном
растворе :
Cr2(SO4)3 → 2Cr3+ + 3SO42-
Под формулой соли написать формулы основания и кислоты, которыми образована соль , и подчеркнуть общий ион в формуле соли и слабого электролита.
Cr2 (SO4)3
Cr (OH)3 + H2SO4
слаб . сильн .
2. Написать сокращенное ионно-молекулярное уравнение гидролиза с участием одного подчеркнутого иона и одной молекулы воды:
Cr 3+ + H + OH - <=> + pH < 7, среда кислая.
3. По полученному сокращенному ионно-молекулярному уравнению написать полное молекулярное уравнение. Для этого каждый ион в сокращенном ионно-молекулярном уравнении дополнить противоположно заряженными ионами соли, которые не участвовали в гидролизе. Написать формулы образующихся веществ, используя правило электронейтральности их молекул, и расставить коэффициенты:
Cr2(SO4)3 + 2H2O <=> 2CrOHSO4 + H2SO4.
б) Используя последовательность написания процесса гидролиза, изложенное в а), составляем сокращенное ионно-молекулярное и молекулярное уравнения гидролиза соли Na 2 S .
Na 2 S диссоциирует в водном растворе:
Na2S → 2Na+ + S2-.
Na2S
NaOH + H2S
сильн . слаб.
Дата: 2018-12-28, просмотров: 357.