ЭЛЕКТРОЛИЗ РАСТВОРОВ
УРОВЕНЬ В
1. Составить схемы электролиза и написать уравнения электродных процессов водных растворов солей (анод инертный): а) хлорида меди ( II ); б) гидроксида натрия.
Какие продукты выделяются на катоде и аноде?
| Дано: а) CuCl 2 , б) Na ОН. Анод инертный |
Решение
а) CuCl 2 = Cu 2+ + 2 Cl - .
Схему электролиза составляем в соответствии с табл. 11.1 и 11.2:
K (-) A (+) инертный
Cu 2+ + 2ē = Cu 2 Cl - – 2ē = Cl 2
H 2 O H 2 O
На катоде выделяется Cu , на аноде – Cl 2 .
б) Na ОН = Na + + ОН-.
K (-) A (+) инертный
Na + 4ОН 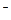 – 4ē = О2 + 2 H 2 О
– 4ē = О2 + 2 H 2 О
2 H 2 O + 2ē = H 2 + 2 OH -
На катоде выделяется Н2, на аноде – О2.
2. Составить схемы электролиза и написать уравнения электродных процессов водного раствора сульфата никеля ( II ) , если: а) анод инертный; б) анод никелевый. Какие продукты выделяются на катоде и аноде?
| Дано: NiSO 4 а) анод инертный б) анод никелевый |
Решение а) анод – инертный NiSO 4 = Ni 2+ + Схему электролиза составляем в соответствии с табл. 11.1. и 11.2: |
| 1. Схема электролиза – ? 2. Продукты электролиза – ? |
K (-) A (+) инертный
Ni 2+ + 2ē = Ni 
2 H 2 O + 2ē = H 2 + 2 OH - 2 H 2 O – 4ē = О2 + 4 H + .
На катоде выделяется Ni и H 2 , на аноде выделяется О2.
б) анод – никелевый:
NiSO 4 = Ni 2+ + 
K(-) A(+) (Ni)
Ni2+ + 2ē = Ni 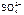 , Н 2 О
, Н 2 О
2H2O + 2ē = H2 + 2OH- Ni – 2ē = Ni2+.
На катоде выделяется Ni и H 2 , на аноде растворяется Ni .
3. При электролизе растворов а) нитрата кальция, б) нитрата серебра на аноде выделяется 560 мл газа (н.у.). Составить схему электролиза и написать уравнения электродных процессов. Определить, какое вещество и в каком количестве выделилось на катоде. Анод инертный.
Дано:
Электролиты:
а) Ca ( NO 3 )2
б) AgNO 3
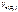 анод = 560 см3
Анод инертный анод = 560 см3
Анод инертный
|
Решение а) Ca ( NO 3 )2 = Ca 2+ + 2 Схема электролиза: K (-) A (+) инертный Ca 2+ 2 H 2 O + 2ē = H 2 O – 4ē = = H 2 + 2 OH - =О2 + 4 H + На катоде выделяется Н2, на аноде выделяется О2. По закону эквивалентов: n эк (В1)(анод) = n эк (В2)(катод) |
1. Схема электролиза
2.  – ?
3. – ?
3.  – ?
4. – ?
4. 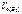 – ? – ?
|
В соответствии со схемой электролиза
n эк (О2)(анод) = n эк (Н2)(катод) или 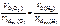 ,
,
Откуда
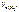 =
= 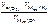 =
= 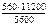 = 1120 см3,
= 1120 см3,
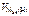 = 11200 см3/моль.
= 11200 см3/моль.
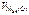 = 5600 см3/моль.
= 5600 см3/моль.
На катоде выделилось 1120 см3 водорода.
Ответ: 1120 см3 водорода.
б) AgNO 3 = Ag + + 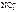 .
.
Схема электролиза:
K (-) A (+) инертный
Ag + + ē = Ag 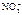
H 2 O 2 H 2 O – 4ē = О2 + 4 H +
На катоде выделяется Ag , на аноде выделяется О2.
По закону эквивалентов: n эк (О2)(анод) = n эк ( Ag )(катод) или
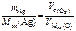 ,
,
Откуда 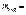
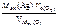 =
= 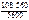 = 10,8 г.
= 10,8 г.
где 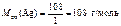 .
.
На катоде выделилось 10,8 г серебра.
Ответ: 10,8 г серебра.
Дано:
Смесь Zn и ZnO
m смеси = 7,27 г
V о( 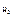 ) = 1,12 л ) = 1,12 л
|
Решение
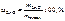 .
.
m ZnO = m смеси – m Zn .
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
УРОВЕНЬ В
Определить температуру, при которой возможен карботермический процесс
PbO (к) + C (к) < = > Pb (к) + CO (г) .
| Дано: Уравнение реакции |
Решение
Приведенный процесс будет возможен, когда относительное давление оксида углерода ( II ) будет равно т.е. РСО = 1.
Поскольку Кр = РСО = 1, то температуру, при которой будет соблюдаться это условие, можно определить из уравнения
–2,303RT lgKp = ΔrHº(298 K) – ΔrSº(298 K).
Так как lgKP = lg 1 = 0, то 0 = Δr Н º (298 K )1000 – Т ΔrS º (298 K )
Откуда 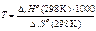 ,
,
Дата: 2018-12-28, просмотров: 340.
 .
.