D fl H o (298 K ) = D r H o (298 K ) = –1410,8 кДж.
Для определения D f H o (298 K , C 2 H 4(г) ) используем первое следствие из закона Гесса для этой же реакции:
D r H o (298 K ) = 2 D f H o (298 K , СО2(г)) + 2 D f H o (298 K , Н2О(ж)) –
– D f H o (298 K , С2Н4(г)) – 3 D f H o (298 K , О2(г)).
Откуда
D f H o (298 K , С2Н4(г)) = 2 D f H o (298 K , СО2(г)) +
+ 2 D f H o (298 K , Н2О(ж)) – D r H o (298 K ) – 3 D f H o (298 K , О2(г)).
Значения стандартных энтальпий образования (Н2О(ж) и СО2(г)) берем из таблицы:
D f H o (298 K , С2Н4(г)) = 2(–393,5) +
+ 2(–285,8) – (–1410,8) = 52,2 кДж/моль.
Ответ: D f H o (298 K , С2Н4(г)) = 52,2 кДж/моль.
3. По заданным термохимическим уравнениям рассчитать стандартную энтальпию образования Fe 2 O 3(к) из простых веществ:
Fe (к) +1/2 O 2(г) = FeO (к) , D r H o (298 K , 1) = – 264,8 кДж. (4.1)
4 FeO (к) + O 2(г) = 2 Fe 2 O 3(к) , D r H o (298 K , 2) = – 585,2 кДж. (4.2)
| Дано: Термохимические уравнения двух реакций | Решение Стандартная энтальпия образования |
Вещества есть тепловой эффект
реакции образования 1 моль
Fe 2 O 3(к) из простых веществ при
стандартныхусловиях. Запишем
термохимическое уравнение реакции образования Fe 2 O 3(к) из простых веществ Fe (к) и O 2(г) :
2 Fe (к) + 3/2 O 2(г) = Fe 2 O 3(к) . (4.3)
Из двух реакций (4.1) и (4.2) необходимо получить реакцию (4.3). Для этого складываем термохимические уравнения (4.1) и (4.2), предварительно умножив на 2 стехиометрические коэффициенты реакции (4.1) и разделив на 2 стехиометрические коэффициенты реакции (4.2):
2 Fe (к) + O 2(г) + 2 FeO (к) + ½ O 2(г) = 2 FeO (к) + Fe 2 O 3(к) .
После сокращения получаем уравнение реакции (4.3):
2 Fe (к) + 3/2 O 2(г) = Fe 2 O 3(к) .
Для определения изменения стандартной энтальпии реакции (4.3) аналогичные математические действия осуществляем с тепловыми эффектами приведенных реакций (4.1) и (4.2):
D r H o (298 K, 3) = 2 D r H o (298 K, 1) + ½ D r H o (298 K, 2) =
= 2(-264,8) + ½(-585,2) = – 822,2 кДж.
Так как реакция (4.3) соответствует образованию 1 моль Fe 2 O 3 из простых веществ, то
D f H o (298 K , Fe 2 O 3 ) = – 822,2 кДж/моль.
Ответ: D f H o (298 K , Fe 2 O 3 ) = – 822,2 кДж/моль.
Дано:
Е ак = 60 кДж/моль а) Т1 = 320 К,
Т 2 = 360 К б) Т = 298 К,
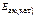 = 48кДж/моль = 48кДж/моль
|
Решение а) Из уравнения Аррениуса получаем где 103 – коэффициент пересчета килоджоулей в Джоули, тогда |
а) 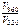 – ?
б) – ?
б) 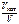 – ? – ?
|
| Дано: Уравнение реакции, Кр = 1 |
Решение CO 2(г) + C (к) <=> 2 CO (г) , |
| Т – ? |
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
УРОВЕНЬ В
Реакция между веществами А и В описывается уравнением
А(г) + 2В(г) = 2С(г).
Константа скорости этой реакции равна 0,1. Начальные концентрации реагирующих веществ со(А) = 0,4 моль/л, со(В) = 0,8 моль/л . Вычислить начальную скорость реакции и определить во сколько раз она изменится, если концентрация вещества А уменьшится на 0,1 моль/л.
Дано:
Уравнение реакции,
К = 0,1
с 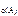 = 0,4 моль/л
с = 0,4 моль/л
с 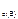 = 0,8 моль/л
с = 0,8 моль/л
с 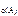 уменьшается
на 0,1 моль/л уменьшается
на 0,1 моль/л
|
Решение
В простейших одностадийных реакциях скорость пропорциональна концентрациям реагирующих веществ в степенях, равных их стехиометрическим коэффициентам в уравнении реакции.
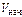 = K· с
= K· с 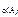 ·
· 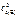 =
=
= 0,1∙0,4·0,82 = = 0,0256 моль/(л∙с).
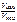 = ?
= ?
Исходные вещества реагируют между собой согласно стехиометрическим коэффициентам в уравнении реакции.
Моль А – 2 моль В
0,1 моль А – х моль В
х = 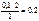 моль.
моль.
Дата: 2018-12-28, просмотров: 311.
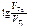 =
= 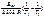 ;
;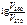 =
= 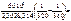 1,09,
1,09,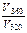 =101,09 = 12,3 раза.
=101,09 = 12,3 раза. 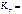
 .
.