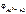 = -1,67 +
= -1,67 + 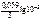 = –1,73 В.
= –1,73 В.
Ответ: 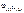 = –1,73 В.
= –1,73 В.
б) Потенциал цинкового электрода, погруженного в раствор своей соли, равен –0,75 В. Вычислить концентрацию ионов цинка в растворе.
Дано:
Металл – Zn
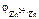 = –0,75 В = –0,75 В
|
Решение
Электродный потенциал цинка рассчитываем по уравнению Нернста:
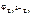 =
= 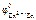 +
+ 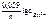 .
.
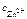 – ?
– ?
Откуда:
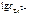 =
= 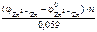
По табл. 11.1 определяем стандартный электродный потенциал цинка:
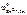 = 0,76 В, n – равно заряду иона цинка Zn 2+ ( n = 2).
= 0,76 В, n – равно заряду иона цинка Zn 2+ ( n = 2).
Тогда
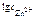 =
= 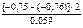 = 0,338.
= 0,338.
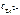 = 100,339 моль/л = 2,18 моль/л
= 100,339 моль/л = 2,18 моль/л
Ответ: 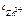 = 2,18 моль/л.
= 2,18 моль/л.
Составить две схемы гальванических элементов (ГЭ), в одной из которых олово служило бы анодом, в другой – катодом. Для одной из них написать уравнения электродных процессов и суммарной токообразующей реакции. Вычислить значение стандартного напряжения ГЭ.
Решение
В гальваническом элементе анодом является более активный металл с меньшим алгебраическим значением электродного потенциала, катодом – менее активный металл с большим алгебраическим значением электродного потенциала.
По табл. 11.1 находим 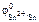 = –0,14 В.
= –0,14 В.
а) Олово является анодом ГЭ.
В качестве катода можно выбрать любой металл с 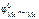 >
> 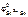 .
.
Выбираем медь 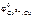 = + 0,34 В. В паре Sn – Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
= + 0,34 В. В паре Sn – Cu олово будет являться анодом ГЭ, медь – катодом. Составляем схему ГЭ:
А(-) Sn │ Sn 2+ ││ Cu 2+ │ Cu (+) K
Или
А(-) Sn │ SnSO 4 ││ CuSO 4 │ Cu (+) K .
Уравнения электродных процессов:
НОК ДМ
На A (-) Sn – 2ē = Sn 2+ 1 – окисление
2
На К(+) Cu 2+ + 2ē = Cu 1 – восстановление
Sn + Cu 2+ = Sn 2+ + Cu – суммарное ионно-молекулярное уравнение токообразующей реакции;
Sn + CuSO 4 = SnSO 4 + Cu – суммарное молекулярное уравнение токообразующей реакции.
Рассчитываем стандартное напряжение ГЭ:
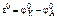 =
= 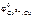 –
– 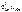 = +0,34 – (–0,14) = 0,48 В.
= +0,34 – (–0,14) = 0,48 В.
б) Олово является катодом ГЭ.
В качестве анода ГЭ можно выбрать любой металл с 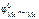 <
< 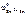 , кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
, кроме щелочных и щелочноземельных металлов, так как они реагируют с водой.
Выбираем магний 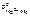 = –2,37 В.
= –2,37 В.
В паре Mg – Sn магний является анодом, олово – катодом.
Составляем схему ГЭ:
А(-) Mg │ Mg 2+ ││ Sn 2+ │ Sn (+) K
Или
А(-) Mg │ MgSO 4 ││ SnSO 4 │ Sn (+) K .
3. Составить схему коррозионного гальванического элемента, возникающего при контакте железа с цинком:
а) в атмосферных условиях (Н2О + О2);
б) кислой среде (Н2 SO 4 );
в) кислой среде в присутствии кислорода ( HCl + O 2 ).
Написать уравнения электродных процессов и суммарной реакции процесса коррозии.
Решение
По табл. 11.1 находим значение стандартных электродных потенциалов железа ( II ) и цинка:
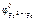 = – 0,44В,
= – 0,44В, 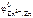 = – 0,76В.
= – 0,76В.
Так как 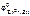 <
< 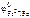 , то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
, то анодом коррозионного гальванического элемента будет являться цинк, катодом – железо.
а) Коррозия в атмосферных условиях ( H 2 O + O 2 ).
Составляем схему коррозионного ГЭ:
А(-) Zn H 2 O + O 2 Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A (-) Zn – 2ē = Zn 2+ 2
4
На К(+) 2 H 2 O + O 2 + 4ē = 4 OH - 1
2 Zn + 2 H 2 O + O 2 = 2 Zn ( OH )2 – суммарное молекулярное уравнение процесса коррозии.
б) Коррозия в кислой среде ( H 2 SO 4 ).
Составляем схему коррозионного ГЭ:
А(-) Zn │ H 2 SO 4 │ Fe (+) K
Или
А(-) Zn │ H + │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A (-) Zn – 2ē = Zn 2+ 1
2
На К(+) 2 H + + 2ē = H 2 1
Zn + 2 H + = Zn 2+ + H 2 – суммарное ионно-молекулярное уравнение процесса коррозии.
Zn + H 2 SO 4 = ZnSO 4 + H 2 – суммарное молекулярное уравнение процесса коррозии.
в) Коррозия в кислой среде в присутствии кислорода ( HCl + O 2 ).
Составляем схему коррозионного ГЭ:
А(-) Zn │ HCl + O 2 │ Fe (+) K
Или
А(-) Zn │ H + + O 2 │ Fe (+) K
Составляем уравнения электродных процессов и суммарной реакции процесса коррозии:
НОК ДМ
На A (-) Zn – 2ē = Zn 2+ 2
4
На К(+) 4 H + + O 2 + 4ē = 2 H 2 O 1
2 Zn + 4 H + + O 2 = 2 Zn 2+ + 2 H 2 O – суммарное ионно-молекулярное уравнение процесса коррозии.
2 Zn + 4 HCl + O 2 = 2 ZnCl 2 + 2 H 2 O – суммарное молекулярное уравнение процесса коррозии.
Дата: 2018-12-28, просмотров: 374.