NO 2 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
| Дано: а) Pb + HNO 3 конц → S + HNO3 конц → б ) P + H2SO4 конц → Mg + H2SO4 конц → |
Решение
а) Pb 0 + HN +5 O 3 конц =
восст. окисл.
= Pb +2 ( NO 3 )2 + N +2 O + H 2 O
НОК ДМ
восстановитель Pb 0 – 2ē = Pb +2 3
6
окислитель N +5 + 3ē = N +2 2
3 Pb 0 + 2 N +5 = 3 Pb +2 + 2 N +2
Переносим полученные коэффициенты в молекулярное урав-нение:
3 Pb 0 + 2 HN +5 O 3(конц) = 3 Pb +2 ( N +5 O 3 )2 + N +2 O + H 2 O .
Поскольку азотная кислота расходуется не только на получение 2 моль NO, но и на получение 3 моль Pb(NO3)2, в которых содержится 6NO 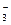 со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3:
со степенью окисления N+5, то для протекания этого процесса необходимо дополнительно 6 моль HNO3:
 6HNO3 ( конц ) + 3Pb0 + 2HNO3( конц ) = 3Pb(NO3)2 + 2NO + H2O
6HNO3 ( конц ) + 3Pb0 + 2HNO3( конц ) = 3Pb(NO3)2 + 2NO + H2O
Суммируем число моль HNO 3 и уравниваем количество водорода и кислорода (4Н2О):
3Р b + 8 HNO 3(конц) = 3 Pb ( NO 3 )2 + 2 NO + 4Н2О.
б) Неметалл + HNO 3(конц) → кислота, в которой неметалл проявляет высшую степень окисления + NO 2 + ( Н2О):
B → H3B+3O3; P → H3P+5O4; S → H2S+6O4; Se → H2Se+6O4;
Si → H2Si+4O3; C → H2C+4O3; As → H3As+5O4.
Решение
So + HN+5O3( конц ) = Н 2 S+6O4 + N+4O2 + H2O
Восст . окисл .
НОК ДМ
восст-ль S º – 6ē = S +6 1
6
окисл-ль N +5 + ē = N +4 6
Sº + 6N+5 = S+6 + 6N+4
S + 6HNO3( конц ) = Н 2 SO4 + 6NO2 + 2H2O.
в) Неметалл + H 2 SO 4(конц) → кислота, в которой неметалл проявляет высшую степень окисления + SO 2 +(Н2 O ); см. пример б).
Решение
P 0 + H 2 S +6 O 4(конц) = Н3Р+5О4 + S +4 O 2 + H 2 O
Восст . окисл.
НОК ДМ
восст-ль P 0 – 5ē = P +5 2
10
окисл - ль S+6 + 2ē = S+4 5
2Р0 + 5S+6 = 2P+5 + 5S+4
2P + 5H2SO4( конц ) = 2 Н 3 РО 4 + 5SO2 + 2H2O.
г) Металл + H 2 SO 4(конц) → соль + ( H 2 S , S , SO 2 )
(в зависимости от активности металла) + Н2О.
H 2 S выделится, если в реакцию вступает активный металл
( Li – Al ),
S выделится, если в реакцию вступает металл средней активности ( Mn –Р b ),
SO 2 выделится, если в реакцию вступает малоактивный металл (стоящий в ряду стандартных электродных потенциалов после водорода).
Решение
Mg0 + H2S+6O4( конц ) = Mg+2SO4 + H2S-2 + H2O.
восст . o кисл .
НОК ДМ
осст - ль Mg0 – 2ē = Mg+2 4
8
окисл - ль S+6 + 8ē = S-2 1
4 Mg 0 + S +6 = 4 Mg +2 + S -2
Аналогично примеру (а) уравниваем реакцию:
4H2SO4( конц ) + 4Mg + H2SO4( конц ) = 4MgS О 4 + H2S + 4H2O
4Mg + 5H2SO4( конц ) = 4MgS О 4 + H2S + 4H2O.
10. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ.
КОРРОЗИЯ МЕТАЛЛОВ.
УРОВЕНЬ В
1. а) Алюминиевый электрод погружен в 5∙10-4 М раствор сульфата алюминия. Вычислить значение электродного потенциала алюминия.
Дано:
Металл – Al
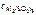 = 5∙10-4 моль/л = 5∙10-4 моль/л
|
Решение
Электродный потенциал алюминия рассчитываем по уравнению Нернста:
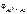 =
= 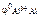 +
+ 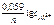
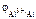 –?
–?
По табл. 11.1 определяем стандартный электродный потенциал алюминия:
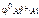 = –1,67 В.
= –1,67 В.
Записываем уравнение электродного процесса, протекающего на поверхности алюминиевого электрода в растворе соли:
Al – 3ē = Al 3+ .
n – число электронов, участвующих в электродном процессе.
Для данной реакции n равно заряду иона алюминия Al 3+ ( n = 3). Рассчитываем концентрацию ионов алюминия в растворе Al 2 ( SO 4 )3:
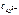 =
= 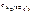 ∙ α ∙
∙ α ∙ 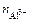 .
.
Разбавленный раствор Al 2 ( SO 4 )3 – сильный электролит.
Следовательно, α = 1. По уравнению диссоциации Al 2 ( SO 4 )3.
Al 2 ( SO 4 )3 = 2 Al 3+ + 3 SO 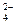
число ионов Al 3+ , образующихся при диссоциации одной молекулы Al 2 ( SO 4 )3, равно 2.
Следовательно, 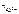 = 2.
= 2.
Тогда 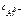 = 5∙10-4∙1∙2 =
= 5∙10-4∙1∙2 = 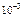 моль/л.
моль/л.
Дата: 2018-12-28, просмотров: 405.