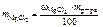УРОВЕНЬ В
1. Сколько граммов хлорида железа ( III ) содержится в 500 см3 0,1 н раствора?
| Дано: с эк ( FeCl 3 ) = 0,1 моль/л (0,1 н) V р-ра = 500 c м3 |
Решение
Молярную концентрацию эквивалентов FeCl 3 определяем по формуле
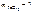
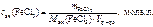 .
.
откуда 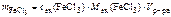 ,
,
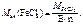
где 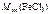 – молярная масса эквивалента хлорида железа ( III ).
– молярная масса эквивалента хлорида железа ( III ).
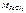 – молярная масса хлорида железа ( III ), г/моль:
– молярная масса хлорида железа ( III ), г/моль:
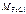 = 56 + 3∙35,5 = 162,5 г/моль,
= 56 + 3∙35,5 = 162,5 г/моль,
В = 3 – валентность железа,
n = 1 – число атомов железа в молекуле соли.
Тогда 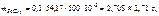
где 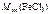 =
= 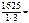 54,17 г/моль;
54,17 г/моль;
10-3 – пересчет кубических сантиметров в литры.
Ответ: 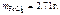
2. Сколько граммов хлорида магния потребуется для приготовления 800 см3 25 %-го раствора плотностью 1,2 г/см3?
Дано:
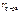 = 800 c м3 = 800 c м3
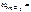 25 % мас. 25 % мас.
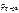 = 1,2 г/см3 = 1,2 г/см3
|
Решение Массовая доля MgCl 2 равна откуда |
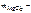 ? ?
|
m р-ра = V р-ра ·ρр-ра = 800·1,2 = 960 г.
Откуда
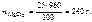
Ответ: 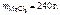
3. Определить молярную концентрацию вещества в растворе, содержащем 40 г сульфата меди ( II ) в 800 см3 раствора.
Дано:
V р-ра = 800 мл
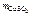 = 40 г = 40 г
|
Решение
Молярную концентрацию С uSO 4 определяем по формуле
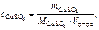 моль/л,
моль/л,
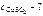
где 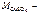 молярная масса сульфата меди ( II ), г/моль.
молярная масса сульфата меди ( II ), г/моль.
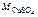 = 64 + 32 + 64 = 160 г/моль.
= 64 + 32 + 64 = 160 г/моль.
Тогда
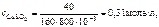
где 10-3 – пересчет кубических сантиметров в литры.
Ответ: 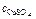 = 0,31 моль/л.
= 0,31 моль/л.
Определить моляльность вещества в растворе, если в 100 г раствора содержится 5,3 г карбоната натрия.
Дано:
m р-ра = 100 г
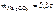
|
Решение
Моляльность Na 2 CO 3 в растворе определяем по формуле
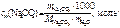 .
.
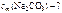
Массу воды определяем из условия
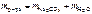 .
.
Тогда
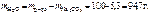
Следовательно,
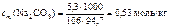 ,
,
Где 1000 – коэффициент пересчета граммов в килограммы.
Ответ: 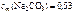 моль/кг.
моль/кг.
5. Определить титр раствора вещества, если в 200 см3 раствора содержится 0,1 моль гидроксида калия.
Дано:
V р-ра = 2 00 c м3
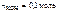
|
Решение
Титр раствора вещества определяем по формуле
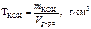 .
.
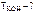
Согласно условию задачи 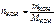 = 0,1 моль,
= 0,1 моль,
откуда m KOH = 0,1· M KOH = 0,1·56 = 5,6 г,
где МКОН – молярная масса гидроксида калия:
М КОН = 39 + 16 + 1 = 56 г/моль.
Следовательно, 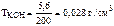 .
.
Ответ: 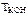 = 0,028 г/см3.
= 0,028 г/см3.
6. Определить молярную долю растворенного вещества в 3,42 %-м растворе сахарозы (С12Н22О11).
Дано:
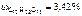
|
Решение Молярную долю сахарозы в растворе определяем по формуле |
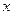 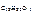 – ? – ?
|
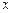
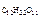 =
= 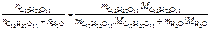 ,
,
где m 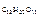 и m
и m 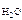 – соответственно массы сахарозы и воды;
– соответственно массы сахарозы и воды;
М 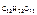 и М
и М 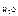 – соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
– соответственно молярные массы сахарозы и воды (342 г/моль и 18 г/моль).
Массы сахарозы и воды определяем согласно условию задачи (3,42 %-й раствор сахарозы).
Следовательно, в 100 г раствора содержится 3,42 г С12Н22О11,
m 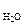 = 100 – 3,42 = 96,58 г.
= 100 – 3,42 = 96,58 г.
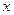
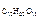 =
= 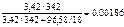 .
.
Ответ: 
 = 0,00186.
= 0,00186.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
УРОВЕНЬ В
Рассчитать изменение стандартных энтальпии и энтропии химической реакции
4 HCl (г) + O 2(г) = 2Н2О(г) + 2С l 2(г)
Дано:
Уравнения химической реакции
Решение
Изменение стандартных энтальпии и энтропии химической реакции рассчитываем на основании первого следствия из закона Гесса:
D r Ho (298 K) – ?
D r S o (298 K) – ?
D r H o (298 K ) = [2 D f Ho (298 K , Н2О(г)) + 2 D f Ho (298 K , Cl 2(г) )] –
– [4 D f H o (298 K , Н Cl (г) ) + D f H o (298 K , О2(г))];
D r S o (298 K ) = [2 S o (298 K , Н2О(г)) + 2 S o (298 K , Cl 2(г) )] –
– [4 S o (298 K , Н Cl (г) ) + S o (298 K , О2(г))],
где D r H o (298 K , В) и S o (298 K , В) – стандартные энтальпии образования и энтропии веществ, которые находим из таблицы:
| 4 HCl (г) | + О2(г) | = 2Н2О(г) | + 2С l 2(г) | |
| D r H o (298 K ) кДж/моль | 4(-92,3) | 0 | 2(-241,84) | 0 |
| S o (298 K ), Дж/(мольК) | 4(186,8) | 205 | 2(188,7) | 2(222,9), |
тогда:
D r H o (298 K ) = 2(–241,84) – 4(–92,3) = –114,48 кДж;
∆ r S o (298 K ) = (2·188,7 + 2·222,9) – (4·186,8 + 205) = –129 Дж/К.
Ответ: D r H o (298 K ) = –114,48 кДж, D r S o (298 K ) = –129 Дж/К.
2. Стандартная энтальпия сгорания этилена (С2Н4) равна
–1410,8 кДж/моль. Написать термохимическое уравнение сгорания этилена и вычислить стандартную энтальпию его образования.
| Дано: D fl H o (298 K , C 2 H 4(г) ) = = –1410,8 кДж/моль |
Решение Составляем реакцию сгорания 1 моль этилена: |
| D f H o (298 K , C 2 H 4(г) ) – ? |
1 C 2 H 4(г) + 3О2(г) = 2СО2(г) + 2Н2О(ж);
D fl H o (298 K ) = – 1410,8 кДж/моль.
Стандартной энтальпией сгорания вещества называется тепловой эффект реакции полного сгорания 1 моль органического вещества до СО2(г) и Н2О(ж) при стандартных условиях.
Дата: 2018-12-28, просмотров: 336.