В медленной стадии нуклеофильного замещения в ароматическом кольце образуются орто-, пара- и мета- s-комплексы (карбанионы). Сравним распределение отрицательного заряда в пара- и мета- s-комплексах (орто-s-комплекс полностью аналогичен пара- s-комплексу)
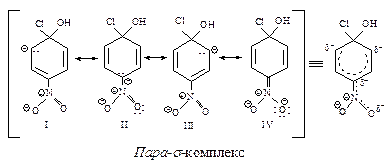
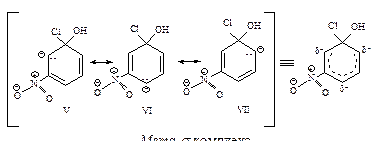
В пара- s-комплексе отрицательный заряд распределен между тремя атомами углерода (граничные структуры I, II, III) и атомом кислорода нитрогруппы (структура IV), так как нитрогруппа связана с атомом углерода, несущим отрицательный заряд. В мета- s-комплексе нитрогруппа не принимает участия в распределении отрицательного заряда, так как она не связана с атомом углерода, несущим отрицательный заряд, следовательно, в мета- s-комплексе отрицательный заряд распределен в меньшей степени (структуры V, VI, VII), чем в пара- s-комплексе, поэтому он образуется медленнее, чем пара- s-комплекс.
В ориентации при нуклеофильном и электрофильном замещении в ароматическом ряду много общего: заместитель оказывает наиболее сильное влияние на скорость замещения, если он находится в орто- или пара-положениях к месту атаки, так как именно в этих положениях возникает максимальный заряд в промежуточном ионе.
МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Получение и строение магнийорганических соединений
При взаимодействии металлического магния с раствором галогенпроизводного углеводорода в сухом диэтиловом эфире C2H5-O-C2H5 образуется магнийорганическое соединение - реактив Гриньяра. В магнийорганических соединениях связь углерод-магний сильно поляризована.
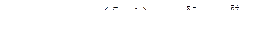
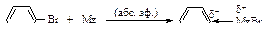
Реактив Гриньяра можно рассматривать как соль очень слабой кислоты - алкана R-H. Соединения, в которых водород связан с кислородом, азотом или углеродом при тройной связи, будут более сильными кислотами, чем алкан, и будут разлагать магнийорганические соединения.
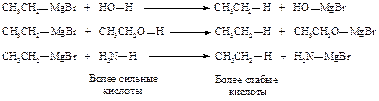
В синтезах с использованием магнийорганических соединений в качестве растворителя используют диэтиловый эфир, высушенный и очищенный от этилового спирта, из которого он был получен (абсолютный эфир). Диэтиловый эфир обладает способностью сольватировать реактив Гриньяра, выступая по отношению к нему как основание.
Синтез спиртов и кислот
Магнийорганические соединения присоединяются к карбонильным соединениям по двойной связи углерод - кислород.
Для синтеза первичных спиртов используют в качестве карбонильного соединения муравьиный альдегид.
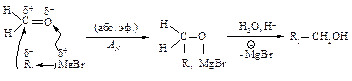
Для получения вторичных спиртов в качестве карбонильного соединения используют соответствующий альдегид.
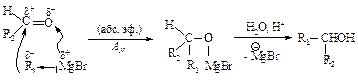
В случае синтеза третичных спиртов исходное карбонильное соединение - кетон.
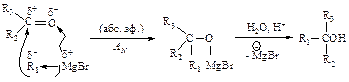
Для получения первичных спиртов, содержащих на два атома углерода больше, чем в магнийорганическом исходном соединении, используют окcид этилена.
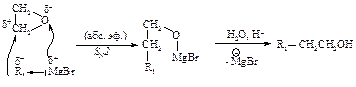
Как выбрать карбонильное соединение для синтеза определенного спирта? Предположим, необходимо получить 2-фенил-2-бутанол. Мысленно расщепляем молекулу спирта около углерода, несущего спиртовую группу. Та часть молекулы, которая содержит кислород, входила в исходное карбонильное соединение, другая - в реактив Гриньяра.
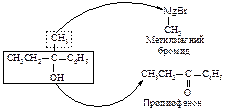
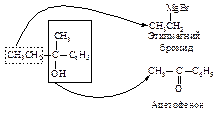
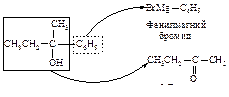
Таким образом, для синтеза указанного спирта можно выбрать три пары соединений.
При взаимодействии реактива Гриньяра с углекислым газом происходит присоединение его по двойной связи, как и в реакции с карбонильными соединениями, в результате образуется соль, из которой карбоновую кислоту выделяют действием разбавленного раствора минеральной кислоты.
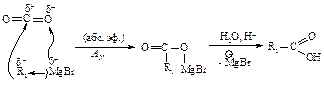
Библиографический список
1.Моррисон, Р. Органическая химия. – М. : Мир, 1974. – 1132 с.
2.Терней, А. Современная органическая химия : 2 т. – М. : Мир, 1991. – Т. 1. – 670 с.; Т. 2. – 615 с.
3.Робертс, Дж. Основы органической химии : в 2 т. / Дж. Моррисон, М. Кассерио. – 2-е изд. – М. : Мир, 1978. – Т. 1. – 842 с.; Т. 2. – 888 с.
4.Шабаров, Ю. С. Органическая химия : в 2 кн. – М. : Химия, 1994. – 848 с.
5.Травень, В. Ф. Органическая химия : 2 т. – М. : ИКЦ Академкнига, 2004. – Т. 1. – 727 с.; Т. 2. – 582 с.
ОГЛАВЛЕНИЕ
| Введение …………………………………………………... | 3 |
| 1. Классификация органических соединений ……………….. | 4 |
| 2. Классификация органических реакций ……………………. | 5 |
| 3. Способы образования ковалентной связи ……………….. | 7 |
| 4. Гибридизация атомных орбиталей и форма органических молекул ……………………………………………………….. | 8 |
| 4.1. sp 3-Гибридизация ………………………………………….. | 9 |
| 4.2. s р2-Гибридизация …………………………………………... | 10 |
| 4.3. sp-Гибридизация …………………………………………… | 11 |
| 5.АЛКАНЫ …………………………………………………….. | 12 |
| 5.1. Физические свойства ……………………………………... | 15 |
| 5.2. Химические свойства ………………………………………. | 16 |
| 5.3. Методы синтеза алканов …………………………………. | 26 |
| 6. СТЕРЕОИЗОМЕРИЯ. ЭНАНТИОМЕРИЯ ……………….. | 29 |
| 6.1. Энантиомеры. Хиральность. Условия хиральности ………. | 29 |
| 6.2. Плоскополяризованный свет. Оптическая активность … | 31 |
| 6.3. Строение молекул и оптическая активность ……………. | 31 |
| 6.4. Обозначение конфигураций ……………………………… | 31 |
| 7. ЦИКЛОАЛКАНЫ …………………………………………... | 35 |
| 7.1 Номенклатура. Изомерия …………………………………. | 35 |
| 7.2. Физические свойства ……………………………………... | 36 |
| 7.3. Типы напряжения ………………………………………… | 37 |
| 7.4. Строение …………………………………………………... | 37 |
| 7.5. Химические свойства …………………………………….. | 43 |
| 7.6. Способы получения ………………………………………. | 45 |
| 8. Алкены ……………………………………………………. | 46 |
| 8.1. Физические свойства ……………………………………... | 47 |
| 8.2. Химические свойства …………………………………….. | 48 |
| 8.3. Способы получения алкенов …………………………….. | 73 |
| 9. ДИЕНЫ ……………………………………………….. | 75 |
| 9.1. Устойчивость сопряженных диенов …………………….. | 76 |
| 9.2. Химические свойства …………………………………….. | 78 |
| 9.3. Способы получения ………………………………………. | 87 |
| 10. АЛКИНЫ …………………………………………….. | 88 |
| 10.1. Физические свойства ……………………………………. | 90 |
| 10.2. Химические свойства …………………………………… | 91 |
| 10.3. Способы получения ……………………………………... | 102 |
| 11. АРЕНЫ ……………………………………………… | 103 |
| 11.1. Сравнение свойств бензола со свойствами алкенов ….. | 103 |
| 11.2. Теплота гидрирования. Энергия резонанса …………… | 104 |
| 11.3. Строение бензола ………………………………………... | 105 |
| 11.4. Ароматичность …………………………………………... | 107 |
| 11.5. Физические свойства ……………………………………. | 107 |
| 11.6. Химические свойства …………………………………… | 109 |
| 11.7. Методы синтеза аренов …………………………………. | 123 |
| 12. Электрофильное замещение в производных бензола ……………………………………………………….. | 125 |
| 12.1. Влияние заместителей на реакционную способность бензольного кольца …………………………………….. | 127 |
| 12.2. Влияние заместителя на выбор места электрофильной атаки ……………………………………………………… | 128 |
| 13. Многоядерные ароматические соединения ……………… | 134 |
| 13.1. Нафталин …………………………………………………. | 134 |
| 13.2. Антрацен и фенантрен …………………………………... | 138 |
| 14. Гетероциклические соединения ……………… | 140 |
| 14.1. Пятичленные гетероциклы ……………………………… | 141 |
| 14.2. Пиридин ………………………………………………….. | 146 |
| 14.3. Хинолин ………………………………………………….. | 150 |
| 15. ГАЛОГЕНАЛКАНЫ ………………………………………. | 152 |
| 15.1. Нуклеофильное замещение ……………………………... | 153 |
| 15.2. Реакции отщепления (элиминирование) ……………….. | 166 |
| 15.3. Методы синтеза галогеналканов ……………………….. | 171 |
| 16. ГАЛОГЕНАРЕНЫ ………………………………………… | 172 |
| 16.1. Причина низкой реакционной способности галогенаренов . | 172 |
| 16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление – присоединение ……………….. | 173 |
| 16.3. Бимолекулярное нуклеофильное замещение SN2Ar …… | 174 |
| 16.4. Ориентация при нуклеофильном замещении в ароматическом кольце ………………………………………… | 176 |
| 17. МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ …………... | 177 |
| 17.1. Получение и строение магнийорганических соединений …… | 177 |
| 17.2. Синтез спиртов и кислот ………………………………... | 178 |
| Библиографический список ………………………... | 180 |
Учебное издание
Органическая химия
Часть 1
УГЛЕВОДОРОДЫ.
ГАЛОГЕНПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Составители: Бетнев Александр Федорович
Колпащикова Ия Семеновна
Кофанов Евгений Романович
Алов Евгений Михайлович
Редактор Л.С. Кокина
План 2007
Подписано в печать 10.07.2012. Формат 60х84 1/16. Бумага белая.
Печать ризограф. Усл. печ. л.14,25 Уч.-изд. л. Тираж 350. Заказ 1714
Ярославский государственный технический университет
150023, Ярославль, Московский пр., 88
Типография Ярославского государственного технического университета
150000, Ярославль, ул. Советская, 14а
Дата: 2018-12-21, просмотров: 353.