Вторая по важности группа реакций алкилароматических углеводородов - свободнорадикальное замещение атома водорода боковой цепи в a-положении по отношению к ароматическому ядру.
Для бензола не характерно свободнорадикальное замещение, так как он не содержит sp3-гибридного углерода. Реакции свободнорадикального замещения аренов: галогенирование, нитрование происходят в боковой цепи (алкильной группе).
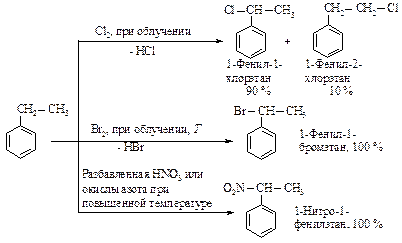
Преимущественное замещение в a-положении объясняется высокой устойчивостью соответствующих алкилароматических радикалов. В этих радикалах имеется возможность распределения спиновой плотности неспаренного электрона между a -углеродным атомом боковой цепи и одним пара- и двумя орто-углеродными атомами ароматического кольца.
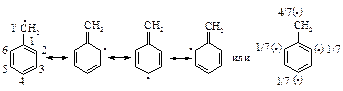
В результате распределения (делокализации) спиновая плотность неспаренного электрона только на 4/7 остается у некольцевого атома углерода, остальные 3/7 спиновой плотности распределены между одним пара- и двумя орто- углеродными атомами ароматического ядра.
Реакции окисления
Реакции окисления в зависимости от условий и природы окислителя могут протекать по-разному. Молекулярный кислород при температуре около 100 оС окисляет изопропилбензол по радикальноцепному механизму.
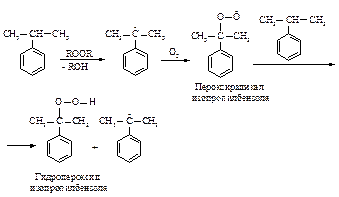
Гидропероксид изопропилбензола можно разложить с образованием фенола и ацетона. Этот процесс разработали ученые Р.Ю. Удрис и П.Г. Сергеев (1942 г.).
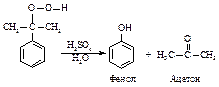
Окисление бензола молекулярным кислородом в присутствии пятиокиси ванадия приводит к образованию малеинового ангидрида.
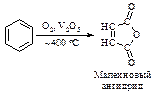
Озон действует на ароматическое ядро так же, как на углеводороды с двойными связями.
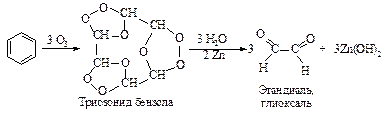
Сильные неорганические окислители (KMnO4, K2Cr2O7 + H2SO4) окисляют боковые цепи алкилароматических соединений до карбоксильных групп, связанных непосредственно с ароматическим кольцом.
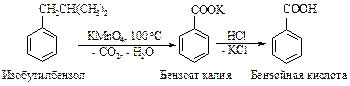
Трет-бутильная группа устойчива к окислению, так как не содержит водорода у a -углеродного атома.
Методы синтеза аренов
Бензол и многие его гомологи содержатся в нефти различного происхождения, в коксовых газах и каменноугольной смоле. В настоящее время в больших масштабах осуществляют дегидрирование, дегидроциклизацию, дегидроизомеризацию или высокотемпературный крекинг алифатических и алициклических углеводородов нефти до аренов.
Ароматизация алканов
Процесс превращения алканов в арены называется дегидроциклизацией, т.к. одновременно включает в себя две реакции: замыкание в цикл линейного углеводорода и отщепление водорода. Из гексана получается бензол, из гептана – толуол, из октана - смесь изомерных ксилолов. Другие арены этим способом не получают.
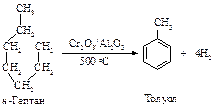
Для получения алкилбензолов существует ряд синтетических методов.
Реакция Вюрца – Фиттига
Аналогично получению алканов по реакции Вюрца алкилбензолы можно получить взаимодействием галогенбензола и галогеналкана с натрием. Наилучшие выходы получаются при использовании арилбромидов и первичных алкилбромидов.
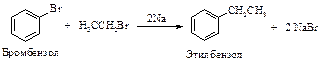
При этом в качестве побочных продуктов получаются бифенил и алкан, но они легко отделимы от алкиларенов.
Гомологи бензола могут быть получены также при взаимодействии фенилмагнийгалогенидов с галогеналканами.
Алкилирование бензола
При действии на бензол алкилирующих агентов (галогеналканов, алкенов, спиртов) в присутствии кислот Льюиса, а также сильных кислот образуется алкилбензол.
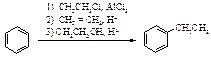
11.7.4.Ацилирование с последующим восстановлением
Реакция ацилирования может быть использована в двухстадийном синтезе алкилбензолов с неразветвлённой цепью атомов углерода: первая стадия - ацилирование, вторая - восстановление полученного кетона амальгамированным цинком в концентрированной соляной кислоте (восстановление по Клеменсену).
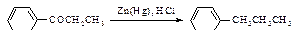
Дата: 2018-12-21, просмотров: 514.