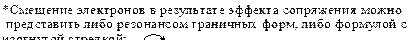Самое сильное влияние любая группа: и активирующая и дезактивирующая оказывает на орто- и пара- положения. Это связано с тем, что в образующемся в медленной стадии s-комплексе именно в орто- и пара-положениях по отношению к вступающему электрофилу возникает положительный заряд.
Электронодонорные группы активируют все положения кольца, и особенно сильно они активируют орто- и пара-положения. Электроноакцепторные группы (кроме галогенов) дезактивируют все положения кольца, но особенно сильно - орто и пара-положения.
Пример 1 . Влияние группы CH3-, проявляющей электронодонорный индукционный эффект (+I). Группа -СН3 подает электроны ко всем атомам кольца, но наибольшее влияние она оказывает на тот атом, с которым непосредственно связана. В карбокатионах (I) и (II) метильная группа, подавая электроны на атом углерода, несущий положительный заряд, в некоторой степени погашает на нем заряд и сама приобретает частичный положительный заряд. В результате в кабокатионах (I) и (II) заряд оказывается распределенным в большей степени, чем в карбокатионе (III). Следовательно, о-, п-s-комплексы (I) и (II) более устойчивы и быстрее образуются, чем м-s-комплекс (III).
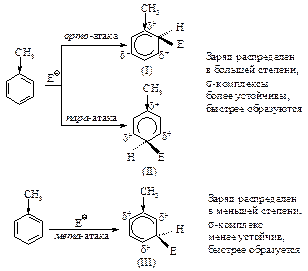
В случае атаки электрофила в мета-положение кольца группа -СН3 не принимает участия в распределении заряда, так как она не связана с положительно заряженным атомом углеродом, поэтому заряд в м- s-комплексе оказывается распределенным в меньшей степени, следовательно, м- s-комплексе менее устойчив, и медленнее образуется, чем о-, п- s -комплексы. Поэтому о-, п-продукты образуются в большем количестве, чем м-продукт.
Пример 2. Сравним устойчивость s-комплексов, образующихся при атаке в орто-, мета-, пара-положения бензольного кольца, содержащего дезактивирующую группу.
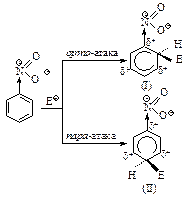
| 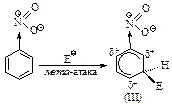
|
Из трех s-комплексов наименее устойчивы о- и п- s-комплексы (I) и (II), так как в них электроноакцепторная группа –NO2 связана с атомом углерода, несущим положительный заряд, она оттягивает электроны от углеродов, которые несут положительный заряд, что ведет к уменьшению устойчивости. В м- s-комплексе электроноакцепторная группа –NO2 не принимает участия в распределении заряда, так как она не связана с положительно заряженным атомом углерода, поэтому заряд в этом s-комплексе оказывается распределенным в большей степени. Это означает, что о- и п- s-комплексы медленнее образуются, чем м-s-комплекс. Соответственно, основным продуктом реакции является продукт мета- замещения.
Рассмотрение механизма ориентации показывает, что все активирующие ориентанты направляют электрофил в орто- и пара-положения, а все дезактивирующие ( кроме галогенов ) - в мета-положение (табл. 12.1).
Почему галогены ведут себя необычным образом? Благодаря слабому электронодонорному эффекту сопряжения (+М ) галогены являются о- и п-ориентантами, как и все группы, содержащие атомы с неподеленной электронной парой (-OH, -NH2 и др.). Однако сильный электроноакцепторный индукционный эффект галогенов (минус I) преобладает над электронодонорным эффектом сопряжения (+M ) и замедляет электрофильное замещение в любом положении кольца, но в орто- и пара-положениях - не слишком сильно из-за стабилизирующего влияния p-р-сопряжения.
Естественно, существуют группы атомов, которые обусловливают смешанную ориентацию. К ним относятся, например, следующие группы: -СН2F, -CHCI2, -CH2NO2, -CH2OH.
Наряду с рассмотренными электронными факторами следует учитывать и пространственные факторы. Монозамещенные производные бензола, содержащие небольшие по размеру электронодонорные ориентанты, взаимодействуют с электрофильными реагентами небольшого объема, образуя смесь о-, п-дизамещенных продуктов в соотношении 2:1 , что соответствует количественному соотношению о-, п-атомов водорода.
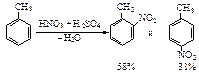
С увеличением объема ориентанта и объема электрофильного реагента уменьшается выход о-замещенного продукта по сравнению с п-изомером. Это объясняется стерическими препятствиями вступлению электрофильного реагента в орто-положение.
Уменьшение выхода о-изомера происходит в ряду ориентантов:
-CH3, -C2H5, -CH(CH3)2, -C(CH3)3;
в ряду электрофильных реагентов:
В случае большого объема электрофила и ориентанта выход о-изомера равен нулю.
При совместном влиянии двух уже имеющихся в кольце групп направление и легкость протекания электрофильного замещения определяется как сумма влияний обеих групп. Наиболее селективное замещение наблюдается при согласованной ориентации.
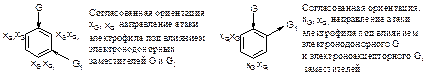
Таблица 12.1
Классификация заместителей. Электронные эффекты
| Ориентанты | Электронные эффекты* | |
| Активирующие орто-, пара-ориентанты | ||
| + M, + I | |
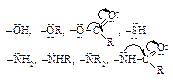
| +M > -I | Ориентанты первого рода |
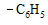
| +M | |

| +I | |
| Дезактивирующие орто-, пара-ориентанты | ||
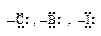
| -I > + M | |
| Дезактивирующие мета-ориентанты | ||
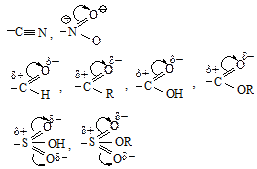
| -I, -M | Ориентанты второго рода |

| -I | |
|
| ||
Пример согласованной ориентации:
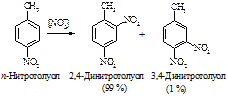
В случае несогласованной ориентации преимущественное направление электрофильного замещения определяется более сильным электронодонорным ориентантом.
Пример несогласованной ориентации:
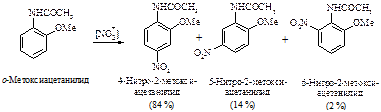
Пример несогласованной ориентации такого типа:
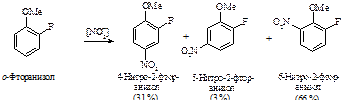
В том случае, если два заместителя находятся в мета-положении по отношению друг к другу, вступающая группа лишь в незначительной степени разместится между ними независимо от их ориентирующего характера. Ниже приведены количества изомеров, образующихся при нитровании.
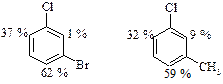
Дата: 2018-12-21, просмотров: 368.