Соединения, содержащие ароматические кольца, которые имеют два общих атома углерода, называются конденсированными. К ним относятся нафталин, фенантрен, антрацен.
Нафталин
Нафталин - двухядерный конденсированный арен.
В молекуле нафталина все атомы лежат в одной плоскости, каждый атом углерода находится в состоянии sp2-гибридизации и связан с соседними атомами углерода и водорода s-связями. В результате перекрывания p-орбиталей образуется p-электронное облако, лежащее над и под плоскостью колец. Число сопряженных p - электронов соответствует правилу Хюккеля N = 4n + 2, где n = 2 и N = 10.
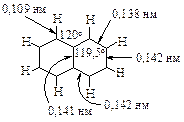
Строение молекулы нафталина можно представить как резонансный гибрид трех структур I, II, III.
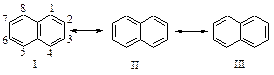
Рассмотрение этих структур показывает, что связи С1 - С2, С3 - С4 , С5 - С6 , С7 - С8 являются двойными в двух структурах и простыми в одной структуре. Связи С2 - С3 и С6 - С7 - простые в двух структурах и двойные - только в одной. Ввиду неполного выравнивания связей энергия сопряжения нафталина меньше, чем энергии сопряжения двух молекул бензола 306 кДж/моль, и равняется 255 кДж/моль.
Нафталин как ароматическое соединение устойчив в реакциях присоединения, характерных для ненасыщенных веществ, и, напротив, подобно бензолу склонен к реакциям электрофильного замещения, в которых сохраняется устойчивая p - электронная система.
Реакции электрофильного замещения в нафталине происходят легче, чем в бензоле, так как в медленной стадии электрофильного замещения в бензоле разрушается сопряжение в 153 кДж/моль, в то время, как при образовании s-комплекса из нафталина потеря энергии сопряжения равняется разности энергий сопряжения нафталина 255 кДж/моль и бензола 153 кДж/моль, то есть составляет 102 кДж/моль. Хлорирование и бромирование происходят настолько легко, что в них не используют катализатор.
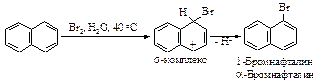
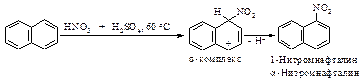
Нитрование и галогенирование нафталина происходят исключительно в a-положение, так как при этом в медленной стадии образуется s -комплекс более устойчивый, чем s -комплекс получающийся при атаке в b- положение: a - s -комплекс может быть изображен с помощью двух граничных структур (I) и (II), в которых сохраняется ароматический секстет, в то время как b - s -комплекс представлен лишь одной граничной структурой с сохранившимся ароматическим секстетом другого кольца.
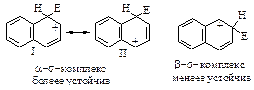
Сульфирование нафталина протекает по двум направлениям. В условиях кинетического контроля (невысокая температура, сравнительно короткое время протекания реакции) образуется преимущественно 1(a)–нафталинсульфоновая кислота. Однако ввиду обратимости реакции ароматического сульфирования и большей термодинамической устойчивости 2(b)–нафталинсульфоновой кислоты по сравнению с 1(a)–нафталинсульфоновой кислотой при повышенной температуре и достаточно продолжительном протекании реакции (условия термодинамического контроля) будет накапливаться наиболее устойчивый, но медленнее образующийся продукт - 2-нафталинсульфоновая кислота.
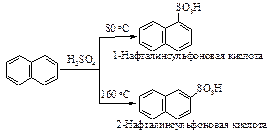
Ориентация в реакциях электрофильного замещения в производных нафталина происходит в соответствии со следующими правилами:
а). Электронодонорная группа, активирующая электрофильное замещение, направляет электрофильный реагент в то кольцо, в котором она находится. Если эта группа находится в положении 1, электрофильный реагент замещает водород в положение 2 или положении 4; электронодонорный ориентант в положении 2 направляет электрофил в положение 1.
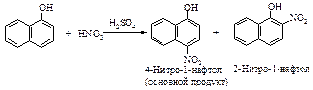
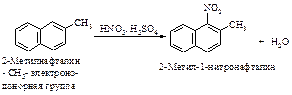
Такое направление замещения можно объяснить следующим образом. Ориентант оказывает наибольшее влияние на то кольцо, с которым он связан. Поэтому наиболее успешной является атака электрофилом EÅ кольца с электронодонорной группой G, в котором может лучше распределиться положительный заряд.
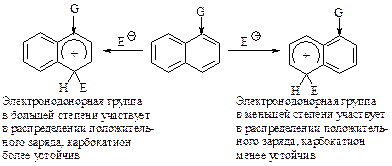
б). Электроноакцепторная группа направляет электрофильный реагент в другое незамещенное кольцо (в положение 5 или 8 при галогенировании и нитровании).
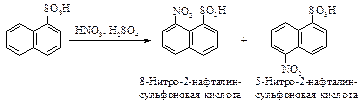
Восстановление нафталина в отличие от бензола можно провести химическими восстановителями. Первая стадия протекает достаточно легко, вторая - восстановление бензольного кольца в тетралине – протекает в жестких условиях, сходных с условиями гидрирования бензола.
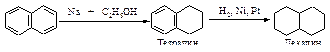
Окисление нафталина кислородом в присутствии пятиокиси ванадия приводит к образованию фталевого ангидрида.
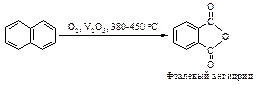
Нафталин окисляется смесью K2Cr2O7 и H2SO4 до фталевой кислоты.
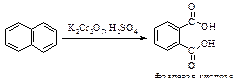
Если в одном из колец есть заместитель, то окисляется кольцо с повышенной электронной плотностью.

Антрацен и фенантрен
Антрацен и фенантрен являются ароматическими соединениями. Они представляют собой плоские циклические структуры, содержащие замкнутое p -электронное облако, расположенное ниже и выше плоскости колец. Число p -электронов в соответствии с правилом Хюккеля равно 4n + 2 = 4 × 3 + 2 = 14.
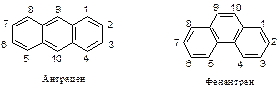
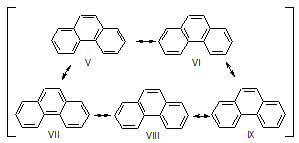
Антрацен можно рассматривать как резонансный гибрид структур I-IV.

Его энергия резонанса составляет 352 кДж/моль.
Фенантрен можно представить резонансным гибридом структур V-IX.
Резонансная энергия фенантрена 386 кДж/моль.
Антрацен и фенантрен вступают в реакции электрофильного замещения. Их активные положения 9 и 10 находятся в среднем кольце, так как при атаке в эти положения сохраняется ароматичность двух боковых бензольных систем с энергией резонанса 153×2=306 кДж/моль. При атаке в боковые кольца сохраняется ароматичность одного нафталинового фрагмента с энергией резонанса 256 кДж/моль.
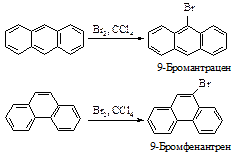
Вывод об активности положений 9 и 10 справедлив как для электрофильного замещения, так и для реакций окисления и восстановления.
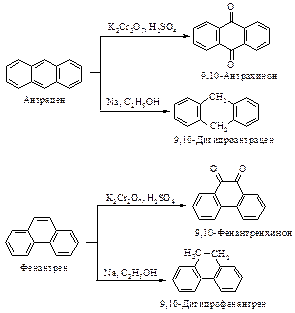
Дата: 2018-12-21, просмотров: 469.