Галогенарены не реакционноспособны в реакциях нуклеофильного замещения, которые характерны для галогеналканов. Низкая реакционная способность галогенаренов обусловлена двумя факторами: (1) делокализацией электронов вследствие резонанса и (2) более высокой энергией s-связи.
1. Хлорбензол можно представить как гибрид граничных структур I-V, причем в структурах III, IV и V хлор связан с атомом углерода двойной связью.
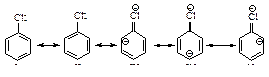
Вклад структур III, IV и V показывает, что углерод и хлор связаны более, чем одной парой электронов, следовательно, связь углерод - хлор является не простой, а кратной.
2. В галогеналканах углерод, соединенный с галогеном, находится в sp3-гибридном состоянии. В галогенаренах атом углерода, связанный с галогеном, находится в sp2-cостоянии, поэтому связь углерод-галоген в галогенаренах короче и прочнее, чем в галогеналканах.
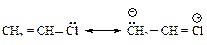
Подобным же образом можно объяснить низкую реакционную способность винилгалогенидов CH2 = CH-X.
16.2. Нуклеофильное замещение, протекающее через стадию образования дегидробензола, - отщепление - присоединение
Нуклеофильное замещение галогена в галогенаренах происходит в жестких условиях. Если хлорбензол ввести в реакцию с очень сильным основанием NH2- в жидком аммиаке, то он превращается в анилин.
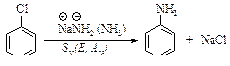
Реакция протекает в две стадии.
Первая стадия - отщепление хлороводорода с образованием дегидробензола.
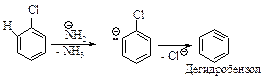
В дегидробензоле дополнительная связь образована между атомами углерода за счет бокового перекрывания sp2-орбиталей, эта связь мало взаимодействует с p -электронным облаком кольца.

Новая связь довольно слабая и дегидробензол очень реакционноспособен.
Вторая стадия - присоединение аммиака к дегидробензолу.
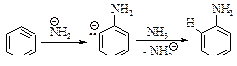
Подтверждением указанного механизма служит следующий факт: хлорбензол с меченым атомом углерода 14С (обозначается С*) в реакции с амидом натрия превращается в анилин, в котором половина молекул содержит аминогруппу при углероде 14С, а половина - при соседнем углероде.
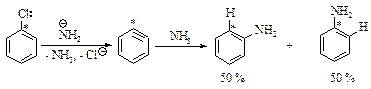
16.3. Бимолекулярное нуклеофильное замещение SN2Ar
Присутствие нитрогруппы в орто- или пара-положении к хлору резко увеличивает его подвижность.
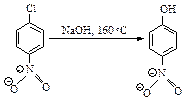
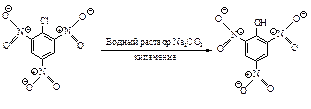
Другие электроноакцепторные группы, расположенные в орто-, пара-положениях, подобно нитрогруппе, активируют галоген. Наоборот, электронодонорные группы будут дезактивировать ароматическое кольцо в реакциях нуклеофильного замещения.
Бимолекулярное нуклеофильное замещение в ароматическом ядре включает две стадии. Первая стадия - медленная: атака нуклеофильного реагента по атому углерода, связанному с галогеном, и образование s-комплекса - карбаниона.
В карбанионе шесть π-электронов делокализованы на р-орбиталях пяти атомов углерода, находящихся в sp2 - гибридном состоянии; избыточная электронная плотность распределена между углеродами в орто-, пара-положениях кольца относительно sp3 - гибридизированного атома углерода (I, II и III структуры) и кислородом нитрогуппы (IV) .
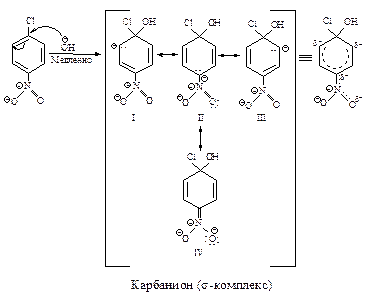
Вторая стадия - быстрая: отщепление аниона галогена, восстановление ароматического шести-p-электронного секстета.
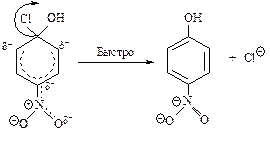
Дата: 2018-12-21, просмотров: 436.