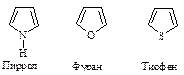
Гетероциклическими называются соединения, содержащие циклы, в которых, кроме атомов углерода, имеются один или несколько атомов других элементов, чаще всего - азота, кислорода, серы.
Пятичленные гетероциклы
Строение
Простейшие пятичленные гетероциклы: пиррол, фуран, тиофен - содержат один гетероатом.
В соответствии с представленными формулами каждое из этих соединений будет обладать свойствами сопряженного диена и соответственно - свойствами амина R-NH-R, простого эфира R-O-R и тиоэфира (сульфида) R-S-R. Однако пиррол не обладает основными свойствами, типичными для аминов, тиофен не вступает в реакции окисления, типичные для сульфидов. Для них характерна способность вступать в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу. Числовые значения теплот сгорания указывают на наличие значительной энергии резонансной стабилизации - 67-117 кДж/моль. Это несколько меньше, чем энергия резонанса бензола (153 кДж/моль), но гораздо больше, чем аналогичная величина для большинства сопряженных диенов (13 кДж/моль). Следовательно, эти соединения являются ароматическими.
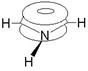
Рассмотрим строение пятичленных гетероциклов на примере пиррола. Четыре атома углерода и атом азота находятся в sp2-гибридном состоянии и затрачивают три гибридные орбитали на образование двух s-связей с другими атомами кольца и одним атомом водорода. У каждого атома углерода остается один электрон, а у атома азота - два на р-орбитали. При p-перекрывании р-орбиталей образуются p-облака выше и ниже плоскости кольца, содержащие шесть электронов, - ароматический секстет.
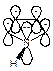
| 
|
Структура пиррола может быть представлена резонансным гибридом структур I-V.
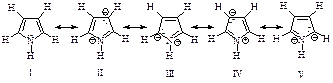
Сравнение дипольных моментов пирролидина 5,18×10-30 Кл×м (1,57Д) и пиррола 5,94×10-30 Кл×м (1,8Д) показывает, что структуры II-V вносят значительный вклад в резонансный гибрид.
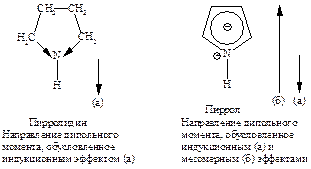
Данные, полученные при измерении длин связей в молекуле пиррола, дипольных моментов, УФ-спектров, теплот сгорания, подтверждают наличие делокализованной p-электронной системы.
Следствием делокализации четырех p-электронов атомов углерода и двух электронов гетероатома является склонность к реакциям электрофильного замещения, в которых сохраняется p-электронная система.
В отличие от вторичных алифатических аминов, для которых КВ»10-3-10-4, пиррол - более слабое основание (КВ =2,5×10-14). Это объясняется тем, что свободная пара электронов азота, которая обусловливает основные свойства азотсодержащих соединений, вовлечена в p-электронное облако и не может быть предоставлена для образования связи с протоном.
Высокая электронная плотность в кольце пиррола обусловливает высокую реакционную способность пиррола в реакциях электрофильного замещения.
Структуры фурана и тиофена аналогичны структуре пиррола. Атом кислорода в фуране и атом серы в тиофене подают два электрона в p-электронное облако и ведут себя как высокореакционноспособные соединения, подобные бензолу.
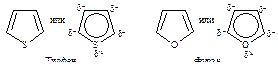
Сравнивая электроотрицательность серы, азота и кислорода, можно ожидать, что вклад структур, подобных II - V, будет наиболее значительным для тиофена и наименее - для фурана, содержащего наиболее электроотрицательный элемент - кислород. Действительно, ароматический характер усиливается при переходе от фурана к пирролу и далее к тиофену, энергии резонанса составляют соответственно 67·103, 88·103, 117·103 Дж/моль. Фуран, наименее ароматичный из этих трех соединений, вступает в реакции диенового синтеза в качестве диена.
14 .1.2. Химические свойства
Пиррол, фуран и тиофен, как и другие ароматические соединения, вступают в реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу.
Пиррол и фуран более реакционноспособные соединения, чем бензол, и сходны с наиболее активными производными бензола: аминами и фенолами. Тиофен менее реакционноспособен, чем пиррол и фуран, но более активен, чем бензол.
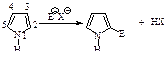
Электрофильное замещение происходит в положение 2.
В реакции электрофильного замещения лимитирующей стадией является стадия образования s -комплекса в результате присоединения электрофильного реагента к атому углерода кольца.
Реакции электрофильного замещения в пирроле представлены на рис. 14.1.
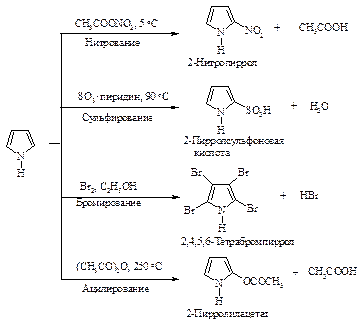
Рис. 14.1. Реакции электрофильного замещения в пирроле
Нитрование и сульфирование пиррола из-за чувствительности к протонным кислотам (это свойство называется ацидофобностью) проводят в отсутствие протонных кислот. Реакция бромирования и ацилирования по Фриделю-Крафту протекает без участия катализатора.
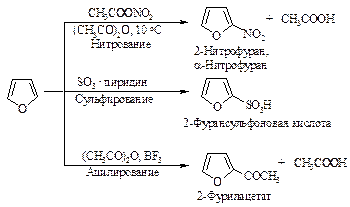
Фуран в реакциях электрофильного замещения напоминает пиррол. Как и пиррол, он является ацидофобным соединением: в присутствии протонных кислот кольцо фурана раскрывается. Хлорирование и бромирование фурана протекает очень бурно и с трудом поддается контролю. Ацилирование требует применения в качестве катализатора мягкой кислоты Льюиса.
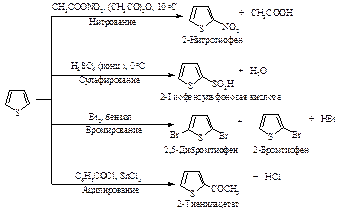
Тиофен менее реакционноспособен по сравнению с фураном и пирролом, он может сульфироваться в условиях высокой кислотности. Бромирование может проводиться направленно с образованием 2-бром- и 2,4-дибромтиофена.
Способы получения
Некоторые замещенные фурана, тиофена и пиррола могут быть получены из ациклических соединений через реакцию циклизации, например:
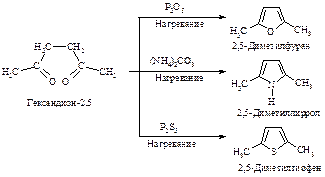
Фуран, тиофен, пиррол могут взаимно превращаться друг в друга (Ю.К. Юрьев) в токе Н2О, Н2S и NH3 соответственно при температуре 400-500 оС в присутствии Al2O3.
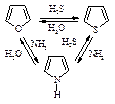
Пиридин
Пиридин является шестичленным ароматическим гетероциклом.
Строение пиридина
В пиридине атом азота, как и все атомы углерода, находится в sp2-cостоянии. Каждый из пяти атомов углерода и атом азота связаны с соседними атомами кольца с помощью двух sp2-гибридизованных орбиталей, третья sp2-гибридизованная орбиталь атома углерода затрачивается на образование связи с атомом водорода, а на третьей sp2-гибридизованной орбитали атома азота находится пара электронов. Пять негибридизованных р-облаков атомов углерода и одно р-облако атома азота, перекрываясь, образуют единую p -электронную систему: два облака - над и под плоскостью кольца.
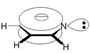
В плоском шестиугольнике пиридина все углерод-углеродные связи имеют одинаковую длину (13,9·10-2 нм), промежуточную между длиной простой Csp 2–Csp 2 (14,8·10-2 нм) и двойной C=C связей (13,4·10-2 нм). Обе связи азот-углерод также имеют одинаковую длину (13,7·10-2 нм), меньшую, чем длина простой связи С-N (14,7·10-2 нм), но большую, чем длина двойной связи С=N (12,8·10-2 нм).
Делокализация шести р-электронов кольца пиридина обусловливает значительную устойчивость p -электронного облака. Действительно, теплота сгорания пиридина указывает на существенную энергию резонанса 96 кДж/моль.
Строение пиридина можно изобразить резонансным гибридом граничных структур I-V.
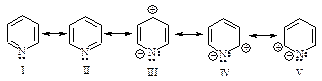
Биполярные структуры III-V вносят значительный вклад в резонансный гибрид, так как дипольный момент пиридина, равный 7,45×10-30 Кл×м (2,26 Д), значительно больше, чем дипольный момент пиперидина 3,86×10-30 Кл×м (1,17 Д).
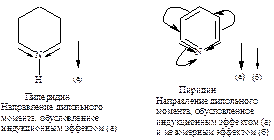
Для пиридина, как для ароматического соединения, характерны реакции электрофильного замещения, в которых сохраняется устойчивая p -электронная система.
Химические свойства
В реакциях электрофильного замещения пиридин ведет себя как сильно дезактивированное производное бензола, подобно нитробензолу. Он нитруется, сульфируется и галогенируется только в очень жестких условиях (более жестких, чем нитробензол). Замещение происходит в положение 3.
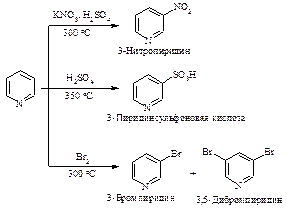
Низкая реакционная способность пиридина, как и нитробензола, объясняется тем, что образующиеся при атаке электрофилом любого положения кольца карбокатионы менее устойчивы, чем карбокатион, возникающий при атаке бензольного ядра, из-за присутствия в кольце электроотрицательного азота. Кроме того, в кислой среде кольцо еще более дезактивируется из-за образования иона пиридиния C6H5NHÅ.
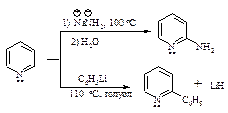
Реакционная способность пиридина в реакциях нуклеофильного замещения настолько велика, что замещению подвергается даже гидрид-ион НӨ. Примером нуклеофильного замещения в пиридине являются реакции Чичибабина: аминирование амидом натрия и арилирование (или алкилирование) с помощью литийорганических соединений.
Атака нуклеофила протекает преимущественно в положение 2 и 4, так как при этом образуется более устойчивый анион: отрицательный заряд частично несет электроотрицательный азот; s-комплекс, возникающий при атаке в положение 3, менее устойчив: ни в одной из граничных структур отрицательный заряд не принадлежит азоту.
Все эти s-комплексы более устойчивы, чем анион, через образование которого происходит нуклеофильное замещение в бензоле. Это обусловлено присутствием в ядре пиридина электроотрицательного азота.
Таким образом, одна и та же причина определяет более низкую реакционную способность пиридина в реакциях электрофильного замещения и более высокую реакционную способность его в реакциях нуклеофильного замещения по сравнению с бензолом.
В пиридине на атоме азота имеется неподеленная пара электронов, которая может обобществляться с протоном. Пиридин является более слабым основанием (КВ=2,3·10-9), чем алифатические амины R1R2NH (КВ~ 10-4). Для объяснения такой зависимости основности от строения можно провести аналогию между электроотрицательностью атома углерода в различных гибридных состояниях и электроотрицательностью атома азота в sp3- и sp2- состояниях:
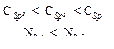
¾¾¾¾¾¾¾®
Электроотрицательность увеличивается
Пара электронов, обусловливающая основность пиридина, занимает sp2-орбиталь атома азота, она находится ближе к ядру. Электроны удерживаются ядром сильнее и менее доступны для обобществления с протоном, чем пара электронов sp3-гибридизованного атома азота.
Благодаря наличию пары электронов на атоме азота пиридин является нуклеофилом и реагирует с галогеналканами с образованием четвертичных солей.
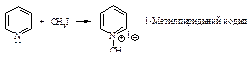
Восстановление. При каталитическом гидрировании пиридина образуется пиперидин С5Н11N.
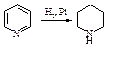
Хинолин
Хинолин представляет собой конденсированную систему, содержащую бензольное и пиридиновое кольца.
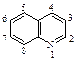
Свойства хинолина соответствуют свойствам нафталина, содержащего электроноакцепторную группу в положении 1.
Хинолин вступает в реакции электрофильного замещения. При взаимодействии со смесью концентрированных азотной и серной кислот происходит нитрование в положения 5 и 8.
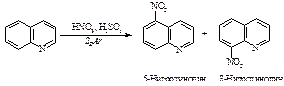
При обработке хинолина дымящей серной кислотой образуются сульфоновые кислоты.
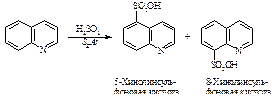
Хинолин так же, как и пиридин, вступает в реакции нуклеофильногозамещения: взаимодействует с амидом натрия и фениллитием.
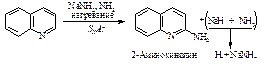
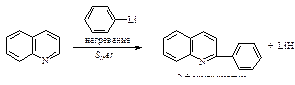
При окислении перманганатом калия образуется дикарбоновая кислота.
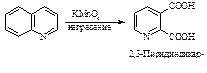
Наиболее удобным путем получения хинолина является метод Скраупа: взаимодействие анилина с глицерином и нитробензолом в присутствии серной кислоты и сульфата железа (II).
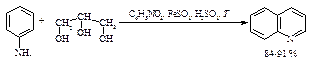
Синтез состоит из следующих стадий.
1). Дегидратация глицерина под действием концентрированной серной кислоты.
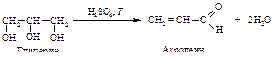
2). Нуклеофильное присоединение анилина к акролеину.

3). Электрофильная атака ароматического кольца электронодефицитным углеродом с последующей дегидратацией образовавшегося спирта.
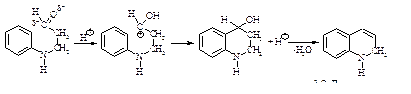
4). Окисление нитробензолом.
Сульфат железа FeSO4 сдерживает бурное течение реакции.
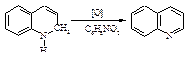
ГАЛОГЕНАЛКАНЫ
Галогеналканы имеют общую формулу СnH2n-1Х, где X - F, Cl, Br, I. Вследствие высокой электроотрицательности галогена связь галоген - углерод является сильно полярной Сd+®Хd-. Галоген, связанный с электронодефицитным углеродом, можно легко заменить на частицу, богатую электронами, - реагент - нуклеофил Nu («ядро любящий»). Нуклеофильными реагентами являются отрицательно заряженные ионы и нейтральные молекулы, имеющие свободную пару электронов.
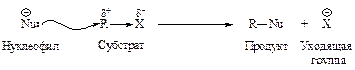
Такие реакции называются реакциями нуклеофильного замещения - SN.
Другой характерный тип превращений галогеналканов - реакции отщепления (элиминирования Е) под действием основания с образованием алкенов. Под влиянием электроотрицательного галогена связанный с ним атом углерода (Сa) приобретает некоторый положительный заряд, на соседнем атоме (Сb) также возникает заряд, но меньший. Тем не менее под влиянием частично заряженного b-углерода находящийся около него водород становится кислым и под действием сильного основания может отщепиться в виде протона (d+>d'+).
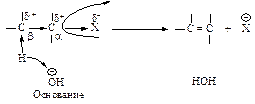
Таким образом, для галогеналканов характерны два главных типа превращений: нуклеофильное замещение и элиминирование. Кроме того, галогеналканы дают магнийорганические соединения R-MgX, важные в синтетическом отношении.
Нуклеофильное замещение
Благодаря доступности галогеналканов и легкости, с которой они вступают в реакции, круг этих реакций очень широк. Наиболее важные из них приведены в таблице 15.1.
Метилгалогениды CH3-X, первичные RCH2-X, вторичные R1R2CH-X, третичные R1R2R3-X алкилгалогениды взаимодействуют с нуклеофильными реагентами по разным механизмам в зависимости от строения алкила.
Таблица 15.1-Реакции нуклеофильного замещения
| Нуклеофил Nu | Продукт реакции R-Nu |
| НО– или Н2О | Спирт ROH |
| R1O- или R1OH | Простой эфир ROR1 |
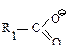
| 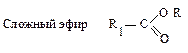
|
| NºC- | Нитрил карбоновой кислоты R-CºN |
| NO2- | Нитросоединение R- NO2 и/или R-ONO |
| NH2– | Амин R-NH2 |
| NH3 | Соль первичного амина RNH3+X- |
| R1NH2, R1R2NH | Соль вторичного или третичного амина RR1NH2+X-, RR1R2NH+ X- |
| R1R2R3NH | Четвертичная аммониевая соль (ЧАС) RR1R2R3N+ X- |
| R1CºC- | Алкины R1CºC-R |
| R1C- | R1C-R (реакция Вюрца) |
| I- | Иодиды R-I |
| SH-, R1–S-, -S–S- | Тиолы RSH, сульфиды R1SR, дисульфиды RSSR |
Дата: 2018-12-21, просмотров: 377.