В соответствии с молекулярной формулой С6Н6 бензол является
ненасыщенным соединением, и можно ожидать, что для него характерна тенденция вступать в типичные для алкенов реакции присоединения. Однако в условиях, в которых алкен быстро вступает в реакции присоединения, бензол не реагирует или реагирует медленно (табл. 11.1).
Бензол не вступает в реакции присоединения, в которых разрушилась бы p-электронная система бензольного кольца. Такая устойчивость называется кинетической. Она связана со значительной энергией активации для реакции присоединения. Чем больше кинетическая устойчивость, тем больше энергия активации и меньше константа скорости.
Таблица 11.1
Сравнение химических свойств циклогексена и бензола
|
Реагент | Циклогексен 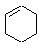
| Бензол 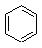
|
| Результат взаимодействия | ||
| KMnO4 (разбавленный водный раствор) | Быстро окисляется | Не реагирует |
| Вг2 (CCl4, в темноте) | Быстро присоединяет | Не реагирует |
| НВr | Быстро присоединяет | Не реагирует |
| Н2 (Ni) | Быстро гидрируется (25 оС; 0,14 МПа) | Медленно гидрируется (200 оС; 10,5 МПа) |
Вместе с тем бензол достаточно легко вступает в реакции замещения. Образующиеся при этом продукты сохраняют специфическую структуру бензола. Таким образом, химические свойства бензола свидетельствуют о необычной стабильности бензола.
Теплота гидрирования. Энергия резонанса
Теплота гидрирования - это количество теплоты, выделяющейся при гидрировании 1 моль ненасыщенного соединения. Теплота гидрирования циклогексена равна 121 кДж/моль.
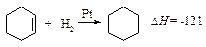
Можно ожидать, что теплота гидрирования 1,3,5-циклогексатриена, содержащего три простые и три независимые двойные связи (гипотетический 1,3,5-циклогексатриен), будет равна утроенной теплоте гидрирования циклогексена: 121·3 = 363 кДж /моль.
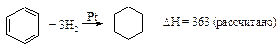
Однако экспериментальная теплота гидрирования бензола составляет 209 кДж/моль, что на 154 кДж/моль меньше расчетной.
Бензол выделяет при гидрировании энергии на 154 кДж/моль меньше, чем было предсказано на основе гипотезы о наличии трех независимых двойных связей. Следовательно, бензол беднее энергией, чем гипотетический 1,3,5-циклогексатриен. Эта энергия называется энергией резонанса. Она определяет термодинамическую устойчивость бензола.
Строение бензола
Согласно теории резонанса, в любом случае, когда строение молекулы может быть изображено несколькими структурами, отличающимися только распределением электронов, ни одна из этих структур не адекватна рассматриваемой молекуле. Молекула представляет собой резонансный гибрид этих структур, называемых граничными. Каждая из граничных структур вносит свой вклад в гибрид: чем устойчивее структура, тем больше ее вклад.
Бензол представляет собой резонансный гибрид двух равноценных граничных структур: (I) и (II).
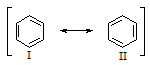
Изображение бензола в виде двух структур вовсе не предполагает их существование. Это означает, что строение бензола не может быть изображено ни структурой (I), ни структурой (II). Бензол имеет строение, промежуточное между ними. Поскольку граничные структуры (I) и (II) эквивалентны, их вклад в резонансную структуру одинаков. Бензол устойчивее, чем любая из граничных структур, на 154 кДж/моль.
Каждый атом углерода в молекуле бензола находится в sp2-гибридном состоянии и связан тремя s-связями с двумя атомами углерода и одним атомом водорода. Атомы углерода и водорода лежат в одной плоскости.
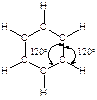
Четвертый валентный электрон атома углерода находится на 2р-орбитали, перпендикулярной плоскости молекулы. Эти 2р-орбитали состоят из двух одинаковых долей, одна из которых лежит выше, другая - ниже плоскости кольца; 2р-орбиталь каждого атома углерода перекрывается с 2р-орбиталями обоих соседних атомов углерода. В результате образуется замкнутая шести-p -электронная система в виде двух “бубликов”, один из которых лежит выше, а другой - ниже плоскости правильного шестиугольника.
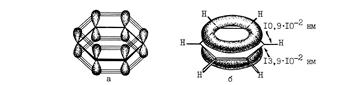
Рис. 11.1. Молекула бензола:
а - перекрывание 2р-орбиталей, образующих p -связи;
б - p-облака в виде двух "бубликов"
Благодаря коллективному взаимодействию всех шести p-электронов происходит выравнивание всех связей С–С по длине и кратности. Все связи углерод-углерод в молекуле бензола являются промежуточными между двойной и простой связями. Длина всех связей С–С в бензоле (13,9×10-2 нм) оказывается промежуточной между длиной двойной связи С=С в алкенах (13,4×10-2 нм) и расчётным значением длины простой связи С(sp2)–С(sp2), равным (14,8×10-2 нм).
Вторым следствием коллективного p-электронного взаимодействия является выигрыш энергии за счет резонанса структур (I) и (II), т.е. электронная и связанная с ней термодинамическая и кинетическая стабилизация бензола.
Ароматичность
Какие свойства должно проявлять вещество для того, чтобы его можно было отнести к ароматическим соединениям? Ароматичность можно определить с точки зрения кинетической устойчивости. Ароматическими называются соединения с молекулярной формулой, указывающей на высокую степень ненасыщенности, которые, однако, не реагируют как ненасыщенные соединения (кинетическая устойчивость), а вступают в реакции электрофильного замещения; для них характерна высокая термодинамическая устойчивость.
Условие ароматичности определяется правилом Хюккеля.
Ароматическими свойствами обладает соединение, если его строение удовлетворяет следующим требованиям:
Дата: 2018-12-21, просмотров: 468.