Свойство соединения существовать в виде энантиомеров называется хиральностью (от греческого “хирос” - рука), а само соединение - хиральным.
Молекула 3-метилгексана не имеет плоскости симметрии и поэтому может существовать в виде энантиомеров (см. рис. 6.1).
Молекула обладает хиральностью, если она не имеет плоскости симметрии. Существует ряд элементов структуры, которые могут сделать молекулу не идентичной своему зеркальному изображению. Наиболее важным из них является хиральный атом углерода.
Хиральный атом или хиральный центр - это атом углерода, связанный с четырьмя различными группами и обозначаемый С*.
Молекула, в которой при атоме углерода находятся две или более одинаковых групп, имеет плоскость симметрии и, следовательно, не обладает хиральностью, поскольку молекула и ее зеркальное изображение идентичны. Такие молекулы называются ахиральными.
Например, изопентан не может существовать в виде энантиомеров и не обладает хиральностью.
Энантиомеры проявляют одинаковые физические свойства, кроме одного. Например, молекула 2-бромбутана существует в виде двух энантиомеров. Они имеют одинаковые температуры кипения, плавления, плотность, растворимость, показатели преломления. Отличить один энантиомер от другого можно по знаку вращения плоскополяризованного света. Энантиомеры вращают плоскость поляризованного света на один и тот же угол, но в разные стороны: один – по часовой стрелке, другой – на такой же угол, но против часовой стрелки.
Энантиомеры обладают одинаковыми химическими свойствами, скорость их взаимодействия с реагентами, не обладающими хиральностью, одинакова. В случае реакции с оптически активным реагентом скорости реакций энантиомеров различны. Иногда они отличаются настолько, что реакция данного реагента с одним из энантиомеров не протекает совсем.
Плоскополяризованный свет. Оптическая активность
Свет представляет собой волну, электромагнитные колебания которой происходят в различных плоскостях. Плоскополяризованный свет - это свет, колебания которого совершаются только в одной плоскости. Обычный свет превращают в плоскополяризованный, пропуская его через поляризатор - призму Николя.
Вещество, которое вращает плоскость поляризованного света, является оптически активным или оптически деятельным.
Оптическую активность вещества можно обнаружить и измерить с помощью поляриметра.
Два энантиомера вращают плоскость поляризованного света на одинаковый угол, но в противоположных направлениях.
Строение молекул и оптическая активность
Проходя через отдельную молекулу, луч поляризованного света взаимодействует с заряженными частями молекулы. Плоскость его при этом поворачивается. В огромном числе беспорядочно ориентированных молекул вещества, не обладающего хиральностью, для каждой молекулы, взаимодействующей с лучом, найдется такая же молекула, которая будет ориентирована, как зеркальное изображение первой. Она, взаимодействуя с лучом, поворачивает плоскость поляризованного света на такой же по величине угол с противоположным знаком, т.е. компенсирует эффект первой. В результате вращения плоскости поляризованного света не наблюдается, вещество оптически неактивно. Таким образом, отдельная молекула взаимодействует с лучом света, но соединение в целом оказывается оптически недеятельным.
Если вещество обладает хиральностью и состоит из единого энантиомера, то ни одна молекула не может быть зеркальным изображением другой. Зеркальное изображение - это другое вещество, его энантиомер. Вращение поляризованного света отдельными молекулами не компенсируется друг другом, и в результате наблюдается оптическая активность.
Обозначение конфигураций
Для этой цели наиболее широко используют символы R и S . Эта система обозначений предложена Р. Каном (Химическое общество, Лондон), К. Ингольдом (Университетский колледж, Лондон) и В. Прелогом (Федеральная высшая техническая школа, Цюрих).
Согласно этой системе, сначала определяют старшинство, или последовательность, заместителей, т. е. четырех атомов или групп, связанных с асимметрическим атомом углерода, исходя из правила старшинства.
Правило старшинства 1. Если с асимметрическим атомом углерода связаны четыре различных атома, то старшинство зависит от атомного номера, причем более старшим будет атом с большим атомным номером. Если два атома являются изотопами одного элемента, то преимущество имеет атом с большим массовым числом. Например, в хлориодметансульфокислоте атомы, согласно их старшинству, располагаются в следующей последовательности: I > С1 > S > Н; в a-дейтероэтилбромиде – Вг > С > О > Н.
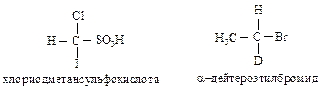
Правило старшинства 2. Если относительное старшинство групп нельзя определить с помощью правила 1, то необходимо провести аналогичное сравнение для следующих атомов в группах (и так далее, если необходимо, двигаясь дальше от асимметрического атома углерода). Иначе говоря, если асимметрический атом углерода связан с одинаковыми атомами, то следует сравнить заместители, связанные с каждым из этих первых атомов. Например, рассмотрим втор-бутилхлорид, в котором с асимметрическим атомом углерода связаны два углеродных атома. В СН3-группе следующими атомами являются Н, Н и Н; в С2Н5-группе – С, Н, Н.
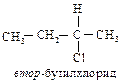
Поскольку углерод имеет больший атомный номер, чем водород, то С2Н5 старше. Таким образом, во втор-бутилхлориде заместители, согласно своему старшинству, располагаются следующим образом: С1 > С2Н5 > СН3 > Н.
В З-хлор-2-метилпентане атомы С, С и Н изопропильной группы старше С, Н и Н этильной группы и полная последовательность заместителей будет следующей: С1 > изопропил > этил > Н.
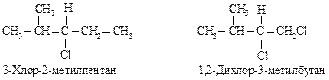
В 1,2-дихлор-З-метилбутане группа СН2Cl старше (С1, Н, Н) изопропильной (С, С, Н). Хлор имеет больший атомный номер, чем углерод, и то, что имеется два атома углерода и только один С1, не имеет значения. (Один больший номер значит больше, чем два или три меньших.)
Правило старшинства 3. Атом, связанный двойной или тройной связью, считается соответственно за два или три атома. Таким образом,
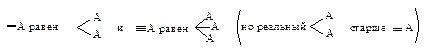
Например, в глицериновом альдегиде ОН-группа является старшей; СНО (О, О, Н) старше СН2ОН (О, Н, Н). Полная последовательность заместителей будет –ОН > –СНО > –СН2ОН > –Н.
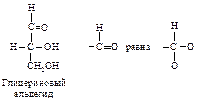
Фенильная группа С6Н5 рассматривается в виде одной из структур Кекуле:
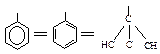
В 1-амино-2-метил-1-фенилпропане, например, фенильная группа (С, С, С) старше изопропильной (С, С, Н), но младше, чем N, который имеет больший атомный номер. Последовательность будет NН2 > С6Н5 > С3Н7 > Н.
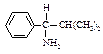
[Согласно правилу, оба атома кратной связи удваиваются (или утраиваются), так что С=О становится 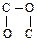 . Это более простое, но менее точное правило достаточно для рассматриваемых примеров.]
. Это более простое, но менее точное правило достаточно для рассматриваемых примеров.]
Например, в случае СНСlВгI с асимметрическим атомом углерода связаны четыре различных атома, и старшинство их зависит только от атомного номера, причем, чем больше атомный номер, тем старше заместитель. Таким образом, в порядке уменьшения их старшинства атомы располагаются в следующем порядке: I > Вг > С1 > Н.
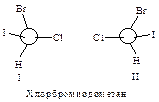
Затем молекулу располагают, так, чтобы младшая группа была направлена от наблюдателя, и рассматривают расположение оставшихся групп. Если старшинство этих групп уменьшается по часовой стрелке, то конфигурацию обозначают символом R (от латинского rectus – правый); если же старшинство этих групп уменьшается против часовой стрелки, то конфигурацию обозначают символом S (от латинского sinister – левый).
Таким образом, конфигурации I и II выглядят следующим образом:
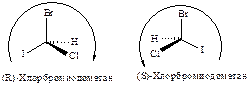
и обозначаются соответственно символами R и S.
Полное название оптически активного соединения отражает и конфигурацию и направление вращения, как, например, (S)-(+)-втор-бутилхлорид. Рацемическую модификацию можно обозначить символом R , S, например (R , S)-втор-бутилхлорид.
Конечно, нельзя путать направление оптического вращения соединения (такого же физического свойства реального вещества, как температура кипения или плавления) с направлением нашего взгляда, когда мы мысленно располагаем молекулу каким-то определенным условным образом. Пока для определенного соединения экспериментально не установлена связь между конфигурацией и знаком вращения, нельзя сказать, знак (+) или (–) соответствует (R)- или (S)-конфигурации.
ЦИКЛОАЛКАНЫ
Углеводороды, которые содержат кольца, состоящие из углеродных атомов, связанных между собой простыми связями, называются алициклическими или циклоалканами (циклопарафинами). Ниже приведена полная и сокращенная запись структурных формул первых четырех представителей ряда циклоалканов.
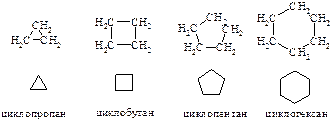
Номенклатура. Изомерия
Названия циклоалканов образуются добавлением приставки цикло- к названию линейного алкана с тем же числом атомов углерода. В алициклических соединениях известны следующие виды изомерии: структурная (изомерия, связанная с различной величиной цикла, различным строением и положением в цикле боковых цепей), пространственная (геометрическая или цис-, транс-изомерия, обусловленная различным расположением групп относительно плоскости кольца) и оптическая (энантиомерия).
Примеры структурных изомеров C6H12:
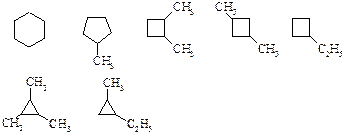
Примеры геометрических изомеров:
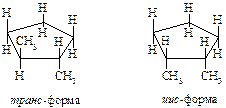
Примеры энантиомеров:
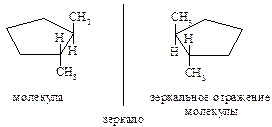
Физические свойства
Физические свойства циклоалканов сходны со свойствами соответствующих ациклических углеводородов, хотя температуры кипения и плавления циклических соединений немного выше. В частности, малые циклоалканы – циклопропан и циклобутан – бесцветные газы, не имеющие запаха, а циклопентан и циклогексан – бесцветные жидкости с Ткип. 50,5 и 80 оС соответственно. Циклоалканы неполярные или малополярные соединения, поэтому они хорошо растворимы в неполярных растворителях, таких как четыреххлористый углерод, эфир, и нерастворимы в сильно полярном растворителе - воде.
Типы напряжения
Несмотря на то, что и алканы и циклоалканы образованы атомами углерода, находящимися в одном и том же состоянии гибридизации (sp 3 ), циклоалканы имеют ряд структурных особенностей. Указанные особенности связаны прежде всего с напряжением молекулы при циклообразовании.
Угловое напряжение (напряжение Байера) – увеличение энергии молекулы, вызванное отклонением угла между связями от величины нормального тетраэдрического угла (109о28′).
Торсионное напряжение (напряжение Питцера, напряжение заслоненных связей) – увеличение энергии, вызванное отклонением конформации любого этанподобного звена в молекуле циклоалкана от заторможенной.
Трансаннулярное напряжение (напряжение Прелога) - увеличение энергии молекулы вследствие взаимодействия несвязанных атомов и фрагментов (двойных связей, функциональных групп и т.д.); такой тип взаимодействия носит также название «взаимодействие через пространство, цикл»
Строение
Теория напряжения А. Байера. В 1885 г. профессор Мюнхенского университета А.Байер предложил теорию, объясняющую некоторые аспекты химии циклических соединений. Часть его теории, рассматривающая способность к раскрытию малых циклов, общепринята и сегодня, хотя сейчас она излагается с других, современных позиций.
Байер рассуждал следующим образом. Когда атом углерода связан с четырьмя другими атомами (sp3-гибридизация), между каждыми двумя связями образуется угол 109о28¢.
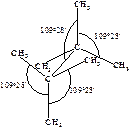
Предполагалось, что в молекулах циклоалканов атомы углерода являются вершинами правильных плоских многоугольников. Циклопропан представляет собой плоский правильный треугольник с углом между связями С–С, равным 60о.
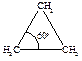
В циклопропане две связи у каждого из атомов углерода не могут образовать нормальный тетраэдрический угол 109о28¢, угол между ними сжат до 60о. Такое отклонение от нормального тетраэдрического угла делает эту молекулу “напряженной” и, следовательно, неустойчивой по сравнению с молекулами с тетраэдрическими углами.
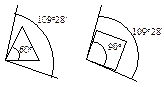
Циклоропан вступает в реакции с раскрытием кольца, поскольку при этом снимается угловое напряжение и образуются более устойчивые ациклические соединения. Чем больше отклонение от нормального угла 109о28¢, тем более “напряженной” является молекула: для циклопропана отклонение составляет 1/2(109о28¢ - 60о)= 24о44¢, а для плоского циклобутана -1/2(109о28¢ - 90о)= 9о44¢.
Поскольку искажение углов наиболее значительно в циклопропане, то он является более “напряженным”, более неустойчивым, более склонным к реакциям, протекающим с раскрытием кольца. Углы в правильном плоском пятиугольнике весьма близки к тетраэдрическим (108о), и поэтому циклопентан практически свободен от углового напряжения.
Углы в правильном плоском шестиугольнике (120о) несколько превышают тетраэдрические, на основании чего Байер предположил (ошибочно), что в циклогексане должно быть некоторое напряжение, а при переходе к циклогептану, циклооктану и т. д. отклонения от угла 109о28¢ будут увеличиваться, вследствие этого молекулы будут становиться все более напряженными.
Как согласуется теория Байера с фактами?
Полезную информацию об относительной устойчивости органических соединений дают теплоты сгорания веществ. Теплота сгорания - это количество теплоты, которое выделяется при сгорании одного моля вещества до улекислого газа и воды. Рассчитано, что для алифатических соединений сгорание метиленового звена -СН2- дает 659,0 кДж×моль -1 .
-СН2- + О2 ® СО2 + Н2О + тепло
В основе классификации циклов, первоначально кажущейся произвольной, лежит зависимость между размером кольца и его устойчивостью.
Если циклопропан и циклобутан выделяют при сгорании больше энергии в расчете на СН2-группу, чем ациклические соединения (соответственно на 38,5 и 27,7 кДж/моль), то это означает, что они содержат больше энергии (см. табл. 7.1). Тогда в соответствии с теорией напряжения Байера циклопропан и циклобутан менее устойчивы по сравнению с ациклическими соединениями, и это обусловливает их склонность к реакциям с раскрытием кольца. В соответствии с теорией Байера циклы большие, чем циклогексан и циклобутан, должны быть неустойчивыми и иметь высокие теплоты сгорания. Но из таблицы 7.1 видно, что теплоты сгорания нормальных и средних циклов в расчете на одну СН2-группу мало отличаются от теплоты сгорания СН2-группы ациклических углеводородов, а для больших циклов - теплота сгорания СН2-группы практически равна этой величине. В противоположность теории Байера ни одна из этих систем не обладает меньшей устойчивостью по сравнению с ациклическими соединениями и не обнаруживает тенденции вступать в реакции раскрытия цикла подобно циклопропану.
Что же неверно в теории Байера? Только одно: Байер считал, что кольцо является плоским, но только трехчленный цикл должен быть плоским. Циклы, содержащие большее число атомов углерода, не обладают плоской конфигурацией.
Что же означает угловое напряжение с позиций современной теории? Для образования связей необходимо такое расположение атомов, при котором орбитали одного атома перекрывались бы с орбиталями другого атома. Чем больше такое перекрывание, тем прочнее связь. Когда углерод связан с четырьмя другими одинаковыми атомами, его sp3-гибридные орбитали направлены к углам тетраэдра. Образование связи происходит в результате перекрывания его sp3-орбитали с аналогичной sp3-орбиталью другого атома. Такое перекрывание наиболее эффективно и связь наиболее прочна, если два атома расположены так, что оси этих sp3-гибридных орбиталей лежат на прямой, соединяющей ядра атомов. В этом случае угол между углерод-углеродными связями С-С-С должен составлять 109о28¢ (рис. 7.1).
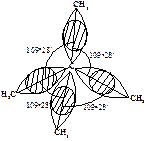
Рис. 7.1. Молекула алкана. Оси sp 3-гибридных облаков лежат на линии, соединяющей ядра атомов
Таблица 7.1
Дата: 2018-12-21, просмотров: 395.