Реакционная способность и селективность
Скорость присоединения протона зависит от устойчивости карбокатиона. Этот фактор определяет относительную реакционную способность различных алкенов: наиболее реакционноспособным должен быть алкен, дающий наиболее устойчивый карбокатион:
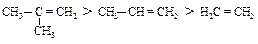
Устойчивость трет-бутилкатиона настолько превосходит устойчивость другого возможного карбокатиона - первичного изобутилкатиона ÅСН2-СН(СН3)2, что в продуктах реакции изобутилена с галогеноводородами обнаруживается только трет-бутилгалогенид. При образовании первичных и вторичных карбокатионов, например, из пропилена или 1-бутена, преобладание вторичных карбокатионов достаточно велико: 85 % вторичного и 15 % первичного.
Перегруппировка
Реакции электрофильного присоединения протекают через стадию образования карбокатионов и могут сопровождаться перегруппировками.
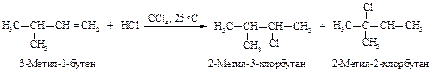
Механизм реакции
Реакция начинается с присоединения электрофила НÅ с образованием карбокатиона.
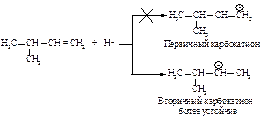
Образовавшийся устойчивый вторичный карбокатион может перегруппировываться в более устойчивый третичный карбокатион. Перегруппировка состоит в переносе гидрид-иона НΘ (протон с двумя электронами) к соседнему атому углерода (1,2-сдвиг).
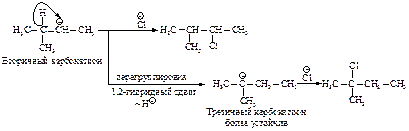
Аналогичным образом может происходить и миграция карбаниона :CH3Ө от соседнего четвертичного атома углерода.
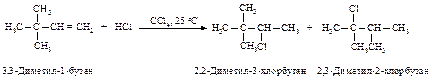
Механизм реакции
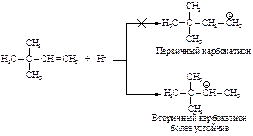
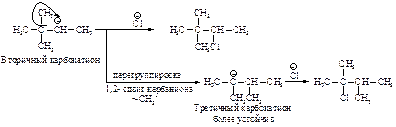
Перегруппировка происходит в том случае, если при 1,2-сдвиге гидрид-иона или отрицательно заряженной CH 3 -группы может образоваться более устойчивый карбокатион.
Поскольку перегруппировки происходят только в карбокатионах, а карбанионы и радикалы не подвергаются перегруппировкам, то можно утверждать: если в результате реакции образуется продукт с иным углеродным скелетом, чем в исходной молекуле, или присоединение происходит не у того атома углерода, у которого была двойная связь, то можно предположить, что реакция протекает с участием карбокатиона в качестве промежуточной частицы.
Присоединение бромистого водорода в присутствии
Пероксидов
В отсутствие пероксидов взаимодействие бромоводорода с алкенами протекает как электрофильное присоединение в соответствии с правилом Марковникова. В присутствии пероксидов алкены реагируют с бромоводородом по другому механизму, и поэтому направление присоединения не соответствует правилу Марковникова.
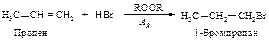
Для того чтобы объяснить перекисный эффект, М. Хараш и Ф. Майо предположили, что присоединение бромоводорода к алкенам может происходить по двум совершенно различньм механизмам: присоединение в отсутствие пероксида - по ионному механизму, а присоединение в присутствии пероксида - по цепному свободнорадикальному.
Механизм реакции
1. Инициирование:
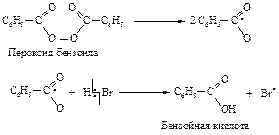
2. Рост цепи:
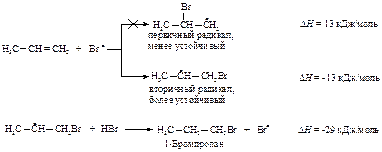
Свободные радикалы, как и катионы, являются электронодефицитными частицами. Алкен предоставляет электроны p-системы для завершения электронной оболочки атома брома. Атом брома присоединяется к алкену и превращает его в свободный радикал. Образовавшийся при этом более устойчивый вторичный углеводородный радикал отщепляет атом водорода от бромоводорода. Теперь присоединение завершено, образовался новый атом брома, чтобы продолжить цепь.
3. Обрыв цепи:
Присоединение бромводорода в присутствии пероксида происходит формально против правила Марковникова потому, что в медленной стадии с алкеном реагирует атом брома.
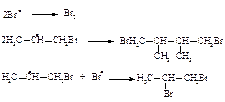
Медленная стадия радикального присоединения бромоводорода в присутствии пероксида:
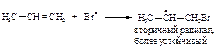
Медленная стадия электрофильного присоединения бромоводорода в отсутствие пероксида:
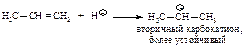
Таким образом, реакции свободнорадикального и электрофильного присоединения подчиняются одному и тому же правилу.
Дата: 2018-12-21, просмотров: 701.