Однако вращение одной метильной группы относительно другой не совсем свободно. Потенциальная энергия молекулы минимальна для заторможенной конформации II, при вращении метильной группы она возрастает и достигает максимума для заслонённой конформации I. Избыток энергии заслонённой конформации по сравнению с заторможенной называют энергией торсионного напряжения. Для молекулы этана эта энергия равна 13·103 Дж/моль (рис. 1.1).
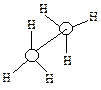
| 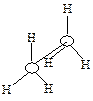
|
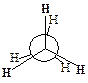
| 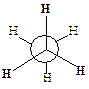
|
| Заслоненная конформация этана (I) | Заторможенная конформация этана (II) |
Считают, что избыток энергии появляется вследствие отталкивания электронных облаков углерод-водородных связей в тот момент, когда они проходят мимо друг друга. Поскольку при комнатной температуре энергия некоторых столкновений молекул может достигать 86·103 Дж/моль, то барьер в 13·103 Дж/моль легко преодолевается. Вращение в этане рассматривают как свободное.
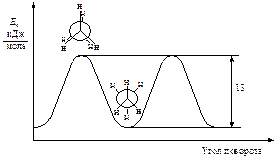
Рис. 5.1. Энергетический профиль вращения групп CH 3 в молекуле этана вокруг связи углерод-углерод
Конформации, соответствующие энергетическим минимумам, называют конформационными изомерами или конформерами. В более сложных молекулах число конформеров может быть достаточно большим.
Физические свойства
Физические свойства алканов определяются их строением. Ковалентные связи в алканах неполярные (С-С) или малополярные (С-Н). Эти связи симметричны, полярность их взаимно компенсируется, поэтому молекула алкана неполярна. Силы межмолекулярного притяжения сравнительно слабы. Это является причиной небольших значений плотности, температуры кипения и плавления.
Температуры кипения, плавления и плотность увеличиваются с увеличением молекулярной массы. Алканы С1 ...С4 - газы, С5 ...С16 - жидкости, далее - твёрдые кристаллические вещества. За исключением низших алканов, температура кипения повышается на 20 - 30 ºС с ростом углеродной цепи на один атом углерода. Такая закономерность изменения температуры кипения характерна для гомологических рядов других классов соединений.
Изомер с разветвлённой цепью имеет более низкую температуру кипения, чем изомер нормального строения.
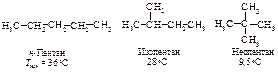
Понижение температуры кипения у изомеров с появлением разветвлений и увеличением их числа объясняется тем, что с увеличением разветвлений форма молекулы стремится к сферической, то есть уменьшается её поверхность, а следовательно, и межмолекулярные силы притяжения. Такая зависимость между формой молекулы и температурой кипения наблюдается и для других классов соединений.
Алканы, неполярные соединения, растворимы в неполярных растворителях (бензол, тетрахлорметан), но нерастворимы в полярных растворителях.
Химические свойства
Химические свойства алканов определяются их строением. В молекулах алканов ковалентные связи малополярные и слабополяризуемые. Поэтому они нечувствительны к ионным реагентам, инертны по отношению к кислотам, основаниям, окислителям. Для взаимодействия с ионными реагентами требуется достаточно высокая полярность атакуемых химических связей, обеспечивающая электростатическое притяжение разноименно заряженных активных центров, и/или способность атакуемой связи поляризоваться под влиянием заряда ионного реагента. Алканы в ничтожной степени обладают и тем и другим свойством.
Наиболее характерным свойством алканов является радикальное замещение незаряженного атома водорода при действии незаряженных радикальных реагентов: атомов хлора и брома при галогенировании, NO2· при нитровании и т.д.
5.2.1. Галогенирование
Замещение водородных атомов на галогены – одна из наиболее характерных реакций предельных углеводородов. Алканы реагируют со всеми галогенами. Со свободным фтором реакция идет со взрывом. Возможны взрывы и в реакциях с хлором. В случае иода процесс ограничен равновесием, так как иодистый водород восстанавливает образующиеся иодистые алкилы.
Галогенирование метана
Хлорирование метана происходит при освещении ультрафиолетовым светом или при повышенной температуре 250 - 400 оС.
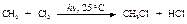
Механизм реакции:
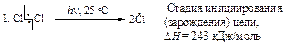
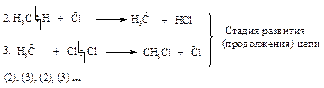
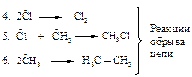
На первой стадии молекула хлора распадается на два атома. Альтернативная возможность разрыва молекулы хлора с образованием ионов хлора (гетеролитический разрыв) не может осуществиться, поскольку для этого требуется значительно большая энергия.
Каждый атом хлора, образующийся в результате гомолитического разрыва связи, сохраняет один электрон из пары, за счет которой осуществлялась ковалентная связь.
Aтом или грyппaатомов, имeющaя нecпaренный электрон, называется свободным радикалом. Неспаренный электрон обозначают точкой.
Атом хлора очень реакционноспособен, так как стремится получить электрон для завершения электронной оболочки. При столкновении с молекулой метана он вырывает атом водорода с его электроном, образуется новый радикал СН3· (стадия 2), который также стремится завершить электронную оболочку и реагирует с молекулой хлора, что приводит к образованию хлористого метила и атома хлора (стадия 3). Реакции 2 и 3 повторяются.
При обрыве цепи реакционная способность реагирующих частиц утрачивается ввиду рекомбинации (объединения) атомов и свободных радикалов в валентно насыщенные молекулы (реакции 4, 5, 6). Поэтому для поддержания реакции требуется постоянное инициирование. В результате рекомбинации двух свободных метильных радикалов образуется побочный продукт - этан. Содержание этана в реакционной смеси невелико, так как стационарная концентрация метильных радикалов, создаваемая в условиях реакции, ничтожна мала.
При хлорировании метана одна реакция инициирования вызывает последовательность реакций, в каждой из которых регенерируется реакционноспособная частица - радикал, вызывающий следующую стадию. Такой механизм называется радикально-цепным. В благоприятных условиях хлорирование метана может пройти от 100 до 10000 циклов прежде, чем произойдет обрыв цепи.
Скорость цепной реакции сильно снижается в присутствии соединений, которые могут взаимодействовать с радикалами и превращать их в мало реакционноспособные частицы. Такие вещества называют ингибиторами. Например, кислород действует как ингибитор.

Радикал СН3ОО· значительно менее реакционноспособен, чем радикал СН3·, и не может продолжать цепь.
Дата: 2018-12-21, просмотров: 348.