Анализ структурной формулы органического соединения позволяет не только определить содержащиеся в нем функциональные группы и установить, к какому классу это соединение относится, но и сделать заключение о геометрической форме его молекулы.
Чтобы ответить на вопрос о пространственном строении молекулы, надежнее было бы воспользоваться результатами экспериментальных измерений длин связей и углов между ними. Часто, однако, пространственная структура молекул или их фрагментов может быть оценена a priori. Например, знание гибридизации орбиталей атомов, образующих молекулы и ионы, позволяет прогнозировать их форму и, наоборот, знание геометрии частиц позволяет делать выводы о гибридизации атомов, образующих эти частицы.
Структурная формула, дополненная обозначением НЭП гетероатомов, однозначно определяет и форму органической молекулы. В 1972 г. Р. Гиллеспи сформулировал теорию отталкивания валентных электронных пар (ОВЭП). Эта теория устанавливает зависимость между геометрией молекулы и отталкиванием пар электронов, как неподеленных, так и участвующих в образовании связей: молекула стремится принять форму, в которой отталкивание электронных пар связей и НЭП является минимальным.
В основе теории ОВЭП лежит концепция гибридизации атомных орбиталей (Л. Полинг, 1931.).
Одно из определений гибридизации атомных орбиталей гласит: «Гибридизация - это способ, с помощью которого молекула принимает геометрию, обусловленную отталкиванием валентных электронных пар». В этом контексте sp3-гибридизация может быть определена как концепция, призванная объяснить эквивалентность С-Н-связей в метане.
Согласно современному определению, гибридизация - смешение валентных (внешних) орбиталей и выравнивание их по форме и энергии.
Теория ОВЭП и концепция гибридизации органично связаны. Эта связь иллюстрируется рядом правил.
4.1. sp 3 -Гибридизация
Если число связей и НЭП у атома в молекуле или частице равно четырем, то атом стремится к их тетраэдрической ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp3-гибридизация его орбиталей. В соответствии с этим четыре С-Н-связи метана образуют тетраэдр; они направлены под углом 109,5° одна к другой, а атом углерода находится в sp3-гибридизации. Схема формирования sp3-гибридных орбиталей атома углерода в молекуле метана представлена на рис. 4.1.
| Потенциал ионизации | 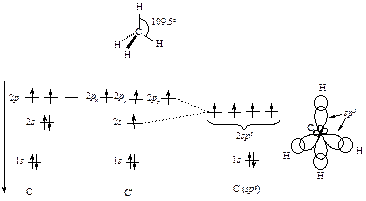
|
Рис. 4.1. Схема формирования s р3 -гибридных орбиталей атома углерода и атомноорбитальная модель метана
Четыре гибридные орбитали атома углерода, перекрывающиеся в молекуле метана с s-орбиталями атомов водорода, образуют s - орбитали. Связи, возникшие в результате перекрывания орбиталей вдоль линии, соединяющей ядра атомов, называют s -связями. Электроны С-Н-связей в молекуле метана находятся, таким образом, на s-орбиталях.
Состояние, близкое к состоянию s р3-гибридизованного атома углерода, характерно и для атомов других элементов, имеющих в органических молекулах число связей и НЭП, равное четырем (H2O, NH3, триэтиламин - N(CH3)3, ион триэтиламмония - NHÅ(СН3)3.
4.2. s р2 -Гибридизация
Если число связей и НЭП у атома в молекуле или частице равно трем, то атом стремится к их тригональной ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp 2 -гибридизация его орбиталей.
| Потенциал ионизации | 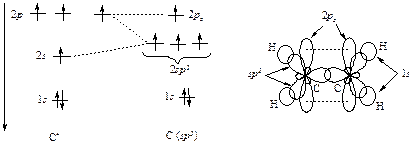
|
Рис. 4.2. Схема формирования s р2- гибридных орбиталей атома углерода и атомно орбитальная модель этилена
В соответствии с этим правилом все атомы в молекуле этилена лежат в одной плоскости, углы между связями равны 120°, а атомы углерода находятся в s р2-гибридизации.
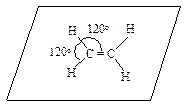
На рис. 4.2 показаны формирование sp 2-гибридных АО атома углерода и атомно-орбитальная модель этилена.
Связи, находящиеся в плоскости молекулы этилена, являются s-связями. 2р z-Орбитали атомов углерода перпендикулярны плоскости молекулы; они не-гибридизированы и образуют π-связъ. Тригональная направленность связей и НЭП характерна и для других функциональных групп, содержащих двойные связи; в каждой из них соответствующие атомы находятся в sp 2-гибридизации.
4.3. sp -Гибридизация
Если число связей и НЭП у атома в молекуле или частице равно двум, то атом стремится к их дигональной ориентации. В этой ориентации отталкивание электронов связей и НЭП является минимальным, а для атома характерна sp -гибридизация его орбиталей.
В соответствии с этим правилом все атомы в молекуле ацетилена лежат на одной прямой, углы между связями равны 180°, а атомы углерода находятся в sp-гибридизации.
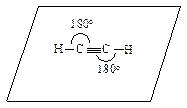
На рис. 4.3 показаны схема sp-гибридизации атома углерода и атомно-орбитальная модель ацетилена.
| Потенциал ионизации | 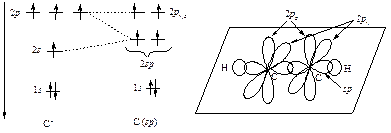
|
Рис. 4.3. Схема формирования sp -гибридных орбиталей атома углерода и атомно-орбиталышя модель ацетилена
И в других линейных молекулах, содержащих тройные связи, s-связи образованы sp-орбиталями, находящимися на оси молекулы, а π-связи образованы 2ру - и 2р z-орбиталями, перпендикулярными оси молекулы (циановодород H-C≡N, нитрилы R-C≡N).
Алканы
Алканами называются углеводороды с открытой цепью, имеющие общую формулу CnH2n+2 и содержащие только простые углерод-углеродные связи. Алканы образуют гомологический ряд, в котором каждый член отличается от предыдущего на постоянную структурную единицу -(CH2)- , называемую гомологической разностью.
Таблица 5.1
Дата: 2018-12-21, просмотров: 452.