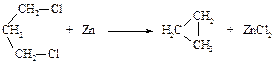
Эта реакция пригодна для получения циклоалканов с n от 3 до 6.
Пиролиз солей дикарбоновых кислот
С помощью пиролиза кальциевых и бариевых солей дикарбоновых кислот могут быть получены циклические соединения с n = 5, 6, 7.
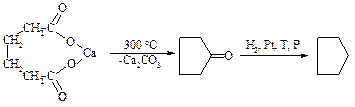
Диеновый синтез
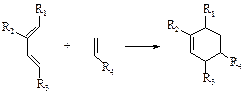
Гидрирование ароматических углеводородов
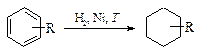
Алкены
Углеводороды состава СnН2n с открытой цепью, содержащие одну двойную связь, называются алкенами. Простейшим углеводородом этого ряда является этилен СН2=СН2. Атом углерода в этилене находится в sp2-гибридном состоянии (тригональный углерод). За счет трех гибридизованных орбиталей каждый атом углерода образует три s-связи: одну - с соседним атомом углерода, две - с двумя атомами водорода. Боковое перекрывания двух 2р-орбиталей атомов углерода дает p-связь и делает невозможным вращение вокруг s-связи углерод-углерод. Этим обусловлено явление геометрической изомерии.
Геометрические изомеры (состав и способ связывания атомов одинаков, расположение групп и атомов в пространстве различно). Для названия этих изомеров используется Е,Z-номенклатура. При этом возможно использование классических цис- и транс-обозначений для определения пространственного расположения одинаковых или сходных групп относительно плоскости сравнения.
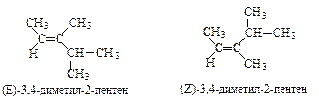
| Одинаковые по старшинству группы расположены по разные стороны от плоскости двойной связи. В этом соединении два метильных радикала находятся в цис-положении. | Одинаковые по старшинству группы расположены по одну сторону от плоскости двойной связи. В этом соединении два метильных радикала находятся в транс-положении. |
Относительное старшинство заместителей при каждом атоме углерода с двойной связью определяется по атомному номеру: Н (атомный номер - 1) - младший, С (атомный номер - 6) - старший заместитель; если атомы при углероде с двойной связью одинаковы, то рассматривается старшинство последующих атомов: - СН3 (последующие атомы - Н, Н, Н) - младший заместитель; -СН(СН3)2 (последующие атомы - Н, С, С) - старший заместитель.
Физические свойства
Физические свойства алкенов в основном сходны с соответствующими свойствами алканов. Алкены нерастворимы в воде, но хорошо растворимы в неполярных растворителях, таких как бензол, тетрахлорметан. Их плотность меньше плотности воды. Так же как и в случае алканов, температуры кипения повышаются на 20 - 30 оС при увеличении длины цепи на один атом углерода (за исключением низших алкенов). Разветвление углеродной цепи в молекулах изомеров понижает температуру кипения (табл. 8.1).
цис-Изомер менее симметричен, чем транс-изомер, поэтому его упаковка в кристаллической решетке менее плотная, что обусловливает, как правило, более низкую температуру плавления цис-изомера.
Алкильная группа подает электроны к углероду с двойной связью. Это объясняется разной гибридизацией атомов углерода. Углерод в состоянии sp 2-гибридизации сильнее притягивает электроны, чем углерод в состоянии sp 3-гибридизации. Поэтому связь поляризована.
Таблица 8.1
Физические свойства алкенов
| Название | Формула | Тпл, ºС | Ткип, ºС | Плотность, г/см3 |
| Этен | СН2=СН2 | -169 | -102,0 | – |
| Пропен | CH2=CH–CH3 | -188 | -48,0 | – |
| 1-Бутен | СН2=СН–СH2–СН3 | -185 | -6,5 | – |
| 1-Пентен | СН2=СН–(СН2)2–СН3 | -185 | 30,0 | 0,643 |
| 1-Гексен | СН2=СН–(СН2)3–СН3 | -138 | 63,5 | 0,675 |
| 1-Гептен | СН2=СH–(СН2)4–СН3 | -119 | 93,0 | 0,698 |
| цис-2-Бутен | 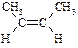
| -139 | 4,0 | – |
| транс-2-Бутен | 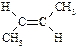
| -106 | 1,0 | – |
| Метилпропен | CH2=C(CH3)2 | -141 | -7,0 | – |
Химические свойства
Атом или группа атомов, которая определяет свойства какого-либо класса органических соединений, называется функциональной группой. В алкенах функциональной группой является двойная углерод-углеродная связь. В алкене более сложном, чем этилен, присутствуют алкильные группы. В определенных условиях алкильные группы в этих молекулах могут вступать в реакции, типичные для алканов. Однако характерными реакциями алкенов являются реакции по двойной углерод-углеродной связи.
Когда имеется сложная молекула с несколькими функциональными группами, то можно ожидать, что свойства этой молекулы будут сочетать свойства различных функциональных групп. Однако свойства отдельной группы будут несколько изменяться под влиянием других групп, и важно понимать эти изменения.
Двойная связь состоит из прочной s-связи и менее прочной p-связи. Типичными реакциями двойной связи являются реакции, в которых происходит разрыв менее прочной p-связи и образование вместо нее двух более прочных s-связей. Такие реакции называются реакциями присоединения. Они обозначаются символом Аd ( Addition - присоединение).
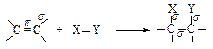
Какие реагенты могут присоединяться к двойной углерод-углеродной связи? Для ответа рассмотрим электронное строение алкенов. Облака p-электронов находятся над и под плоскостью, в которой лежат атомы углерода и водорода. Эти электроны наиболее доступны для реагентов с недостатком электронов. Двойная углерод-углеродная связь служит донором электронов, т.е. ведет себя как основание*. Она реагирует с соединениями, которые обеднены электронами, т.е. с кислотами. Эти реагенты, не имеющие пары электронов, называются электрофильными реагентами (электрофил - любящий электроны). Следовательно, типичными реакциями алкенов являются реакции электрофильного присоединения (AdE).
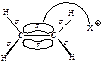
Существуют реагенты другого типа, также обедненные электронами - свободные радикалы. С ними алкены вступают в реакции радикального присоединения (AdR) .
Большинство алкенов содержит алкильные группы, которые являются остатками алканов, следовательно, такие алкены могут подобно алканам участвовать в реакциях свободнорадикального замещения атома водорода в алкильном остатке (SR).
Реакция электрофильного присоединения протекает в две стадии:
I стадия - медленная, присоединение электрофила ЕÅ с образованием карбокатиона.
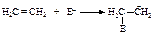
II стадия - быстрая, присоединение нуклеофила Nu (нуклеофил - любящий ядро).
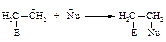
По такому механизму протекает реакция присоединения галогеноводородов НСl, НВr, НI.
Для присоединения воды к алкенам необходим катализатор - сильная минеральная кислота, которая дает протон НÅ - электрофил, а нуклеофилом является вода (Н2О) за счет неподеленной пары электронов на атоме кислорода. Подобным образом с алкенами реагирует спирт (RОH), который также имеет неподеленную электронную пару на атоме кислорода. В реакции с серной кислотой быстрая стадия - взаимодействие с нуклеофилом —ОSO2OH.
Присоединению хлора и брома, молекулы которых неполярны, предшествует поляризация
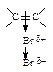
Под влиянием электронного облака двойной углерод-углеродной связи изменяется распределение электронной плотности в молекуле галогена. В первой медленной стадии присоединяется электрофил Br+, во второй - нуклеофил Br—.
Частицы, присоединяющиеся в медленной и быстрой стадиях электрофильного присоединения, приведены в таблице 4.2.
Таблица 4.2.
Реакции электрофильного присоединения
| Реакции присоединения | |||||
| Реагент | галогенов | галоген- водородов | воды | спиртов | серной кислоты |
| Электрофил | Cl+ Br+ | H+ | H+ | H+ | H+ |
| Нуклеофил | Cl— Br— | Cl— , Br—, I— | Н2O | ROH | — ОSO2OH |
Присоединение галогенов
Алкены реагируют с бромом и хлором в инертном растворителе (например, в четыреххлористом углероде), образуя вицинальные дигалогениды (vicinalis - соседний).
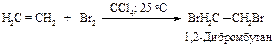
Этот процесс протекает как электрофильное присоединение.
Механизм реакции
Первая стадия. Неполярная молекула галогена поляризуется под действием богатой электронами двойной углерод-углеродной связи. Изменение распределения электронной плотности в одной молекуле под влиянием внешних условий (растворитель, другие молекулы, ионы) называется поляризацией. Поляризованная таким образом молекула галогена взаимодействует с p-cистемой, образуя p-комплекс:
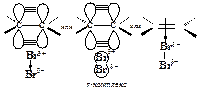
Вторая стадия. p-Комплекс разрушается, ион брома ВrÅ- электрофил - присоединяется к атому углерода и образуется s-комплекс - карбокатион. Вторая стадия - медленная, определяет скорость всего процесса.
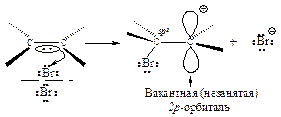
Положительно заряженный атом углерода находится в sр2-гибридизованном состоянии (его 2р-орбиталь не занята). Свободная 2р-орбиталь перекрывается с неподеленной парой электронов атома брома, образуя циклический ион бромония.
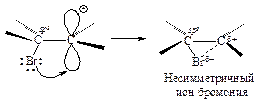
Третья стадия. Оставшийся анион брома (нуклеофил - ядро любящий) атакует образовавшийся циклический ион бромония по второму атому углерода.
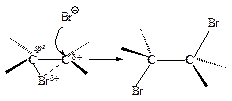
Стадия 2 – медленная, с высокой энергией активации
Доказательствами справедливости этого механизма служат следующие факты:
1). При проведении бромирования в растворе, содержащем помимо аниона брома другой нуклеофил (например, анион хлора), в продуктах реакции появляется наряду с дибромидом соединение, содержащее хлор.
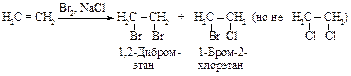
8 .2.1.2. Реакционная способность галогенов в реакции А d Е
Присоединение хлора и брома к алкенам происходит легко и во многих случаях с количественным выходом. Присоединение йода к алкенам осуществить не удается. Взаимодействие фтора с алкенами происходит так энергично, что углеводород распадается на осколки с меньшим числом атомов углерода.
Дата: 2018-12-21, просмотров: 419.