Галогенирование алканов протекает по такому же механизму, как и галогенирование метана.
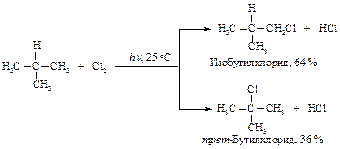
Рассмотрим механизм хлорирования изобутана.
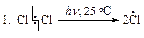
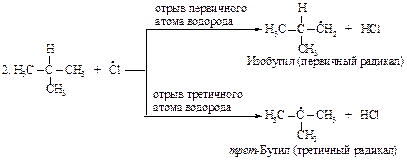
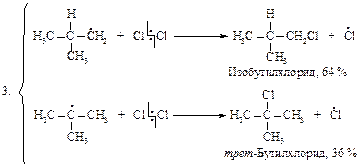
Затем (2), (3), (2), (3)... до обрыва цепи. Стадии обрыва цепи напишите самостоятельно.
Бромирование изобутана приводит к соответствующим бромидам, но в другом соотношении.
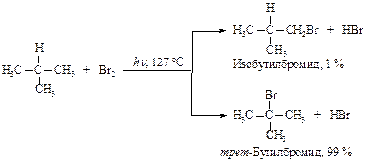
Объясните, почему для реакции бромирования необходима более высокая температура.
Частота столкновений атома галогена с молекулой изобутана одна и та же для обоих превращений. В молекуле изобутана девять первичных и только один третичный. Если бы все атомы водорода обладали одинаковой реакционной способностью по отношению к атому галогена, то первичные атомы реагировали бы в девять раз чаще, чем третичные. Фактор вероятности благоприятствует образованию изобутилхлорида и трет-бутилхлорида в соотношении 9:1. Экспериментальные данные дают соотношение 1,8:1 или 9:5. Это означает, что результативных столкновений атомов хлора с третичным атомом водорода в пять раз больше, чем с первичным. Следовательно, энергия активации для отщепления третичного атома меньше, чем для отщепления первичного.
Образование третичного радикала более экзотермично, протекает с меньшей энергией активации. Это связано с меньшей затратой энергии на разрыв третичной связи C–H по сравнению с первичной связью C–H.
Подобным образом сравнение количеств изомеров, образующихся при хлорировании алканов, содержащих первичные и вторичные атомы водорода, позволяет сделать вывод о том, что вторичный радикал образуется легче, чем первичный.
Следовательно, относительная легкость отщепления атомов водорода такова: третичный > вторичный > первичный > Н–СН3.
Ряд легкости образования радикалов изменяется в порядке: третичный > вторичный > первичный > · CH3 .
Сопоставление энергий, необходимых для отрыва третичного, вторичного, первичного и H-CH3 атомов водорода от молекулы R-H, показывает: для отрыва третичного атома водорода требуется меньше энергии, чем для отрыва вторичного и т.д. Это означает, что устойчивость третичного радикала по отношению к его родоначальному углеводороду выше устойчивости вторичного радикала и т.д. Отсюда выводим ряд устойчивости радикалов: третичный > вторичный > первичный > · СН3.
Легкость образования радикалов соответствует порядку изменения устойчивости радикалов. Чем устойчивее радикал, тем легче он образуется.
Различная устойчивость радикалов обусловлена делокализацией неспаренного электрона в результате его взаимодействия с электронами С-Н-связей соседних атомов углерода.
Бромирование протекает с высокой избирательностью, относительные скорости замещения первичного, вторичного и третичного атомов водорода имеют такие значения: 1:82:1600. При атаке молекулы углеводорода малореакционноспособным атомом брома переходное состояние достигается поздно, оно имеет радикальный характер. Факторы, стабилизирующие свободные радикалы, в такой же степени стабилизируют переходные состояния, а это означает, что различие в энергиях активации и скоростях образования первичного, вторичного и третичного радикалов достаточно большое.
При атаке молекулы углеводорода реакционноспособным атомом хлора переходное состояние достигается рано, алкильная группа имеет незначительный свободнорадикальный характер. Факторы, стабилизирующие радикалы, не проявляются в заметной степени в переходном состоянии, следовательно, различие в энергиях активации и скоростях образования первичного, вторичного и третичного радикалов невелико (относительные скорости 1:3,8:5). Реакция протекает с низкой степенью селективности.
Дата: 2018-12-21, просмотров: 438.