Расчет количества вещества эквивалента аналогичен расчету количества вещества:
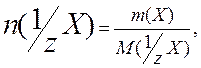
где M(1/zX) – молярная масса эквивалента вещества.
Соотношение между величинами n (Х), М(Х), n (1/ z X ) и M (1/ z X ).
Молярная масса эквивалента определяется:
M(1/zX)=1/zM(X),
соответственно:
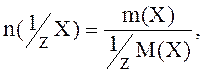
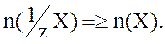
Количество вещества эквивалента не может быть меньше количества вещества.
Пример 5. Рассчитать какое количество вещества эквивалента соединений составит: а) 25г H3PO4; б) 30г H3PO4, если в реакции с КОН получают соль К2НРО4; в) 40г Cr2(SO4)3.
Решение.
а) величина z для H3PO4 составляет 3, тогда
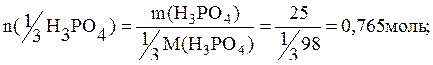
б) величина z=2, тогда
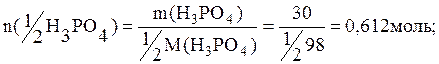
в) величина z для сульфата хрома (III) составит: z=q·n=3·2=6, тогда
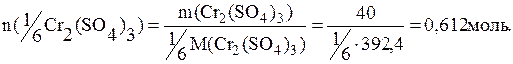
Ответ: 0,765моль, 0,612моль, 0,612моль.
Расчеты состава вещества по закону эквивалентов
При использовании закона эквивалентов для расчета состава веществ закон эквивалентов выражается в виде: n(1/zA)= n(1/zB), для соединений типа АрВq.
Пример 6. При восстановлении оксида меди массой 8г выделилось 1,8г воды. Определить: 1) молярную массу эквивалента меди; 2) массовый состав оксида меди.
Решение.
CupOq+qH2=qH2O+pCu (схема реакции)
Сначала находим значения m(Cu) и n(1/zCu). Примем формулу оксида – CupOq.
Рассчитываем значения n(1/zCu). По закону эквивалентов:
n(1/zCu)=n(1/2О)= n(Н)= n(Н2О)·2=0,1·2=0,2моль
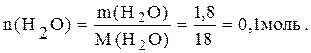
Величина m(Cu)= m(CupOq)-m(О)=8,0-1,6=6,4г;
m(О)= n(1/2О)·М(1/2О)=0,2·8=1,6г.
Все значения для расчета ω(Cu) уже получены.
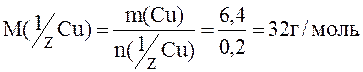
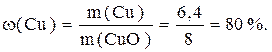
Ответ: ω(Cu)=80%.
Молярная концентрация эквивалента – это количество вещества эквивалента, содержащегося в 1 л раствора:
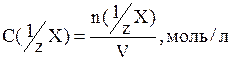
где n(1/zX) – количество вещества эквивалента, моль.
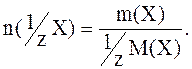
Молярная концентрация эквивалента всегда больше или равна молярной концентрации. Это положение используется при проверке полученных данных.
Молярную концентрацию эквивалента часто называют нормальной и обозначают 1н.; 0,5н. и т.д.
Пример 7. Рассчитать молярную концентрацию эквивалента в растворе HCl, если масса HCl=287,5г.
Решение.
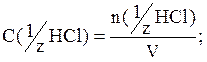 фактор эквивалентности HCl =1
фактор эквивалентности HCl =1
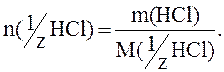
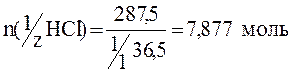
Если объем раствора не задан, то удобно принимать его равным 1л.
Отсюда, 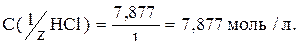
Ответ: С(1/zНСl)=7,877моль/л.
Расчетные задачи по уравнениям химических реакций
Все расчеты проводятся на основании закона эквивалентов.
Перед началом расчета:
1) производится запись уравнения реакции или схемы реакции (расчет по закону эквивалентов не требует уравнения реакции);
2) определяются факторы эквивалентности всех участвующих в реакции веществ;
3) производится количественный расчет.
Пример 8. Рассчитать: 1) массу серной кислоты, достаточной для нейтрализации 20,8г Са(ОН)2; 2) массу выделившегося при этом сульфата кальция; 3) массу воды.
Решение.
По закону эквивалентов:
n(1/2H2SO4)=n(1/2CaSO4)=n(Н2О)=n(1/2Ca(OH)2);
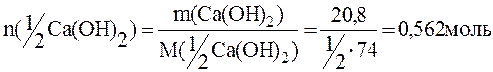
Рассчитываем массы H2SO4, CaSO4, H2О:
m(H2SO4)=n(1/2H2SO4) M(1/2H2SO4)=0,562·1/2·98=27,54г,
m(CaSO4)2=n(1/2CaSO4) M(1/2CaSO4)=0,562·1/2·136=38,212г,
m(H2О)=n(H2О) M(H2О)=0,562·18=10,11г.
Ответ: m(H2SO4)=27,54г, m(CaSO4)2=38,212г, m(H2О)= 10,11г.
Дата: 2018-12-21, просмотров: 659.