 Вода – очень слабый электролит, диссоциирует на ионы в очень малой степени:
Вода – очень слабый электролит, диссоциирует на ионы в очень малой степени:
 С учетом гидратации протона:
С учетом гидратации протона:
При расчетах для простоты вместо иона гидроксония Н3О+ пишут протон Н+.
Запишем выражение для константы диссоциации воды:
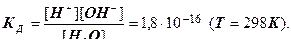
Молярная концентрация воды – постоянная величина:
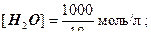
K Д [H 2 O] = [H +][OH –] ; 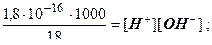
[H +][OH –] = 10–14 = 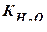 – ионное произведение воды.
– ионное произведение воды.
Такое соотношение между произведением концентраций ионов Н+ и ОН– существует в любом растворе: и в растворе кислоты, и в растворе щелочи, а не только в воде.
В чистой воде [H +] = [OH –] = 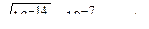
Эта величина очень мала. Отсюда следует, что из 10 млн. молекул Н2О диссоциирует на ионы только одна молекула.
Проводить расчеты с такими малыми величинами неудобно, поэтому Зëренсен в 1909г. предложил заменить их логарифмическими обозначениями, ввел понятия водородный показатель рН и гидроксильный показатель рОН:
рН = – lg[H +] или рН = 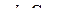
pOH = – lg[OH –] или рОН = 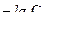
Т.к. [H +][OH –] = 10–14 , то в любом растворе при 250С рН + рОН = 14.
Все эти обозначения приводят к так называемой шкале pH.
В нейтральной среде: [H +] = [OH –] = 10–7  , pH = – lg 10–7 = 7.
, pH = – lg 10–7 = 7.
В кислой среде: [H +] > [OH –] ; [H +] > 10–7, pH < 7.
В щелочной среде: [H +] < [OH –] ; [H +] < 10–7, pH > 7.
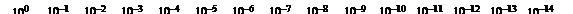
[H +]моль/л
pH

рН – очень важный показатель постоянства внутренних сред организма человека.
В норме рН крови и спинномозговой жидкости 7,36 – 7,44
Желудочного сока около 0,9
Слюны 6,8
Сока поджелудочной железы 7,5 – 8,0
Желчи в пузыре 5,4 – 6,9
Мочи 4,8 – 7,5
При расчете рН растворов кислот сначала рассчитывают концентрацию ионов водорода по формуле:
[Н+] = α · С(1/z) кислоты,
где α – степень электролитической диссоциации кислоты, выраженная в долях единицы,
С(1/z) кислоты – молярная концентрация эквивалента раствора кислоты.
Далее рассчитывают рН.
При расчете рН растворов щелочей сначала рассчитывают концентрацию гидроксид-ионов по формуле:
[ОН–]= α · С(1/z) щелочи,
где α – степень электролитической диссоциации щелочи, выраженная в долях единицы,
С(1/z) щелочи – молярная концентрация эквивалента раствора щелочи.
Затем рассчитывают рОН и далее рН.
Пример 1. Рассчитайте нормальную концентрацию раствора соляной кислоты, если рН этого раствора равен 4.
Решение.
[Н+] = 10–рН = 10–4 моль/л; [Н+] = α · С(1/z) кислоты,
α = 1, 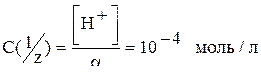 .
.
Ответ: 10-4моль/л.
Пример 2. Рассчитайте рН 0,01н раствора новокаина, проявляющего слабые основные свойства, если степень электролитической диссоциации равна 1%.
Решение.
α = 1% = 0,01; [ОН–]= α ∙ С(1/z) основания = 0,01 ∙ 0,01 = 10-4 моль/л;
рОН = – lg [ОН–] = – lg 10-4 = 4; рН = 14 – 4 = 10.
Ответ: 10.
Пример 3. Рассчитайте нормальную концентрацию раствора слабой щелочи, если рН этого раствора равен 11, а степень электролитической диссоциации равна 10%.
Решение.
рОН = 14 – рН = 14 – 11 = 3. [ОН–] = 10-рОН = 10-3 моль/л
[ОН–]= α ∙ С(1/z) щелочи; α = 10% = 0,1
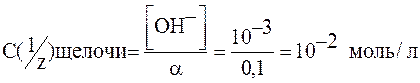 .
.
Ответ: 10-2 моль/л.
Пример 4. Концентрация ионов водорода Н+ в растворе равна 4•10-4 моль/л. Вычислить рН и рОН.
Решение.
1) Вычисляем рН раствора:
рН = – lg [Н+] = – lg (4•10-4) = – (lg 4 – 4 lg 10) = – 0,60 + 4,00 = 3,40
2) Определяем рОН по формуле рН + рОН = 14:
рОН = 14 – 3,40 = 10,60.
Ответ: рН=3,4 и рОН=10,6.
Контрольные вопросы и задания
1. Что такое ионизация воды? Запишите ионное произведение воды.
2. Что такое водородный показатель – рН; рОН растворов сильных кислот и оснований?
3. Как рассчитать рН растворов слабых кислот, оснований?
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 92 – 107 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 575 – 577 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 208 – 209 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 50 – 52 с.
Задания для самостоятельного решения
1. Рассчитайте рН 0,01 н раствора азотной кислоты, если степень электролитической диссоциации равна 100 %.
Ответ: 2
2. Найдите рН 0,1 н раствора уксусной кислоты, если степень электролитической диссоциации равна 1%.
Ответ: 3
3. Чему равны рН и рОН 0,001 н раствора сильной кислоты, если a= 1?
Ответ: рН = 3; рОН = 11.
4. Рассчитайте рН 0,1 н раствора салициловой кислоты, если степень электролитической диссоциации равна 10%.
Ответ:2
5. Рассчитайте рН 0,01 н раствора сульфаниловой кислоты, если степень электролитической диссоциации равна 10 %.
Ответ: 3
6. Чему равен pH 0,01 н раствора NaOH, если α = 1?
Ответ: 1 2
7. Рассчитайте рН 0,0001 н раствора гидроксида калия, если степень электролитической диссоциации равна 100%.
Ответ: 10
8. Чему равен рН 0,01 н раствора слабой щелочи, если α = 10% ?
Ответ: 11
9. Рассчитайте рН 0,001 н раствора гидроксида аммония, если степень электролитической диссоциации равна 10%.
Ответ: 10
10. Рассчитайте рН 0,01 н раствора новокаина, проявляющего слабые основные свойства, если степень электролитической диссоциации равна 1%.
Ответ: 10
11. Рассчитайте рН 0,01 н раствора веронала, проявляющего слабые основные свойства, если степень электролитической диссоциации равна 0,1%.
Ответ: 9
12. Рассчитайте рН 0,001 н раствора уротропина, проявляющего слабые основные свойства, если степень электролитической диссоциации равна 0,1%.
Ответ: 8
13. К 99 мл воды добавили 1 мл 0,1 н раствора HCl. Как изменилось значение рН ?
Ответ: 7 - 3
14. К 99 мл воды добавлен 1 мл 0,1 н раствора NаОН. Как изменилось значение рН ?
Ответ: 7 - 11
15. рН морской воды равен 8. Рассчитайте концентрацию гидроксид-ионов в моль/л.
Ответ: 10-6
16. рН желудочного сока равен 1. Найдите активную кислотность и концентрацию гидроксид-ионов в моль/л.
Ответ: 10-1; 10-13
17. рН томатного сока равен 4. Рассчитайте активную кислотность в моль/л.
Ответ: 10–4
18. рН дистиллированной воды при контакте с воздухом, откуда она поглощает углекислый газ, равен 6. Рассчитайте концентрацию гидроксид–ионов в моль/л.
Ответ: 10–8
19. pH=2. Чему равны 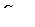 ,
, 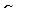 и рОН ? Какова среда раствора?
и рОН ? Какова среда раствора?
Ответ: 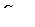 =10–2 моль/л ;
=10–2 моль/л ; 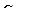 =10–12 моль/л; рОН=12; среда кислая
=10–12 моль/л; рОН=12; среда кислая
20. pH = 11. Чему равны 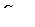 ,
, 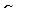 и рОН ? Какова среда раствора?
и рОН ? Какова среда раствора?
Ответ: 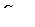 =10–11 моль/л ;
=10–11 моль/л ; 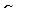 =10–3 моль/л; рОН=3; среда щелочная
=10–3 моль/л; рОН=3; среда щелочная
21. pOH = 3. Чему равны 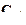 ,
,  и рН ? Какова среда раствора?
и рН ? Какова среда раствора?
Ответ: 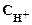 =10–11 моль/л ;
=10–11 моль/л ;  =10–3 моль/л; рН=11; среда щелочная
=10–3 моль/л; рН=11; среда щелочная
22. рН раствора одноосновной сильной кислоты равен 2. Найдите активную кислотность и нормальную концентрацию кислоты в растворе.
Ответ: 10–2 моль/л; 0,01н
ЗАНЯТИЕ 15
Дата: 2018-12-21, просмотров: 1986.