1. Определить молярную концентрацию раствора H2SO4 с массовой долей растворенного вещества ω(H2SO4)=20% и ρ=1,14г/мл, если объем раствора равен 1л.
Ответ: 2,3моль/л
2. Определить молярную концентрацию раствора H3PO4 с массовой долей растворенного вещества ω(H3PO4)=15% и ρ=1,1г/мл, если объем раствора равен 1л.
Ответ: 1,68моль/л
3. Определить молярную концентрацию раствора Ca(OH)2 с массовой долей растворенного вещества ω(Ca(OH)2)=10% и ρ=1,08г/мл, если объем раствора равен 1л.
Ответ: 1,46моль/л
4. Определить молярную концентрацию раствора Na2SO4 с массовой долей растворенного вещества ω(Na2SO4)=8% и ρ=1,05г/мл, если объем раствора равен 1л.
Ответ: 0,6моль/л
5. Определить молярную концентрацию раствора AgNO3 с массовой долей растворенного вещества ω(AgNO3)=5% и ρ=1,01г/мл, если объем раствора равен 1л.
Ответ: 0,297моль/л
6. Определить молярную концентрацию и молярную концентрацию эквивалента раствора LiCl с массовой долей растворенного вещества ω(LiCl)=15% и ρ=1,1г/мл, если объем раствора равен 1л.
Ответ: 3,89моль/л; 3,89моль/л
7. Определить молярную концентрацию и молярную концентрацию эквивалента раствора H2SO4 с массовой долей растворенного вещества ω(H2SO4)=25% и ρ=1,16г/мл, если объем раствора равен 1л.
Ответ: 2,96моль/л; 5,9моль/л
8. Определить молярную концентрацию и молярную концентрацию эквивалента раствора Вa(OH)2 с массовой долей растворенного вещества ω(Вa(OH)2)=12% и ρ=1,08г/мл, если объем раствора равен 1л.
Ответ: 0,75моль/л; 1,5моль/л.
9. Определить молярную концентрацию и молярную концентрацию эквивалента раствора AlCl3 с массовой долей растворенного вещества ω(AlCl3)=16% и ρ=1,12г/мл, если объем раствора равен 1л.
Ответ:1,35моль/л; 4,04моль/л.
10. Определить молярную концентрацию и молярную концентрацию эквивалента раствора AgNO3 с массовой долей растворенного вещества ω(AgNO3)=20% и ρ=1,14г/мл, если объем раствора равен 1л.
Ответ: 1,34моль/л; 1,34моль/л.
11. Смешали 0,5л раствора NaOH c ω(NaOH)=30% и ρ=1,332г/мл и 1л раствора NaOH с С(NaOH)=2моль/л. Определить молярную концентрацию и молярную концентрацию эквивалента полученного раствора.
Ответ: 4,66моль/л.
12. Смешали 0,8л раствора КOH c ω(КOH)=20% и ρ=1,176г/мл и 0,5л раствора КOH с С(КOH)=3моль/л. Определить молярную концентрацию и молярную концентрацию эквивалента полученного раствора.
Ответ: 3,74моль/л.
13. Смешали 0,92л раствора CaCl2 c ω(CaCl2)=18% и ρ=1,158г/мл и 1,5л раствора CaCl2 с С(CaCl2)=4моль/л. Определить молярную концентрацию и молярную концентрацию эквивалента полученного раствора.
Ответ: 3,19моль/л; 6,58моль/л.
14. Смешали 1л раствора HNO3 c ω(HNO3)=36% и ρ=1,225г/мл и 1,75л раствора HNO3 с С(HNO3)=4,5моль/л. Определить молярную концентрацию и молярную концентрацию эквивалента полученного раствора.
Ответ: 5,4моль/л.
15. Смешали 1,25л раствора H2SO4 c ω(H2SO4)=60% и ρ=1,503г/мл и 1,8л раствора H2SO4 с С(H2SO4)=5моль/л. Определить молярную концентрацию и молярную концентрацию эквивалента полученного раствора.
Ответ: 6,72моль/л; 13,44моль/л.
16. Для нейтрализации 50мл раствора щелочи с С(1/zщелочи)=0,2моль/л потребовалось 20мл раствора кислоты. Определить молярную концентрацию эквивалента кислоты.
Ответ: 0,5моль/л.
17. Для нейтрализации 70мл раствора щелочи с С(1/zщелочи)=0,3моль/л потребовалось 30мл раствора кислоты. Определить молярную концентрацию эквивалента кислоты.
Ответ: 0,7моль/л.
18. Для нейтрализации 95мл раствора щелочи с С(1/zщелочи)=0,32моль/л потребовалось 50мл раствора кислоты. Определить молярную концентрацию эквивалента кислоты.
Ответ:0,608моль/л.
19. Для нейтрализации 100мл раствора щелочи с С(1/zщелочи)=0,4моль/л потребовалось 60мл раствора кислоты. Определить молярную концентрацию эквивалента кислоты.
Ответ: 0,67моль/л.
20. Для нейтрализации 120мл раствора щелочи с С(1/zщелочи)=0,43моль/л потребовалось 65мл раствора кислоты. Определить молярную концентрацию эквивалента кислоты.
Ответ: 0,793моль/л.
ЗАНЯТИЕ 12
Ионные равновесия в растворах
Слабых электролитов. Закон разбавления Освальда.
План занятия
1. Проверка посещаемости и информация
2. Контрольная работа по теме “Молярная концентрация эквивалента”
3. Устный опрос и коррекция знаний
4. Самостоятельная работа по написанию уравнений ступенчатой диссоциации кислот, солей и оснований.
5. Лабораторная работа 3 «Растворы электролитов и ионные равновесия»
6. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Закон разбавления Освальда
Существует взаимосвязь между константой К и степенью ионизации слабых электролитов α:
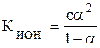
Для слабых электролитов α – величина малая, поэтому выражение
(1–α)→1,
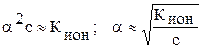
Зная Кион, легко вычислить концентрацию ионов, степень ионизации электролита и наоборот.
Пример 1. Вычислить концентрацию ионов Н+ и СN- – в 0,1м растворе, если КHCN = 7,2∙10-10.
Решение.
1) В водном растворе синильная кислота распадается на ионы:
HCN↔H+ + CN-
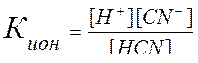
2) Обозначим концентрацию ионов через x, тогда [Н+]=[СN-]=х, а концентрация неионизированных молекул [CHN]=с–х:
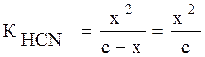
так как с–х→с,
х=[Н+]=[СN-]= 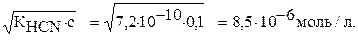
Ответ: концентрация ионов [Н+]=[СN-]=8,5∙10-6моль/л.
Пример 2. Вычислить степень ионизации 0,1 М раствора HCN, если
КHCN = 7,2 •10-10.
Решение.
1) Степень ионизации рассчитаем по формуле:
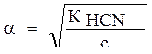
2) Подставим значения:
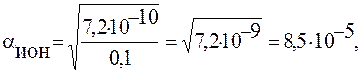
или 8,5∙10-5∙102 = 0,0085%.
Этот пример можно решить и по-другому. Если известна концентрация ионов (см. пример выше), то α можно вычислить так:
с α = [Н+] = [СN-] = 8,5∙10-6 моль/л.
Тогда
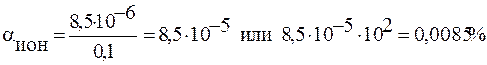
Ответ: αион(HCN)=0,0085%.
Пример 3. Степень ионизации 0,1м раствора гидроксида аммония равна 1,33%. Вычислить концентрацию ионов ОН- и константу ионизации.
Решение.
1) В водном растворе NH4OH распадается на ионы:
NH4OH↔NH4++OH-.
2) Степень ионизации α рассчитываем:
α = сион/собщ;
подставим числовые значения:
1,33∙10-2 = сион/0,1
[ОН-] = сион = 1,33∙10-3 моль/л.
3) Подставляя в выражение Кион
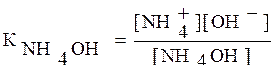
числовые значения, получаем:
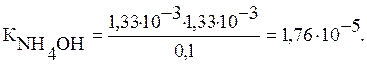
Ответ: Кион=1,76∙10-5.
Пример 4. Во сколько раз изменится концентрация ионов водорода [Н+], если к 1л 0,1н раствора муравьиной кислоты НСООН добавить 0,1м формиата натрия НСООNa (учитывая, что степень ионизации формиата при таком разбавлении близка к 100%)?
Решение.
1) Определяем концентрацию ионов водорода в 0,1м растворе муравьиной кислоты до прибавления соли:
НСООН↔НСОО- + Н+
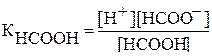
Концентрация ионов водорода может быть вычислена по формуле:
[Н+] = 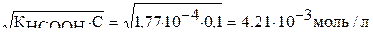
2) Рассчитываем концентрацию ионов водорода после добавления соли.
Обозначим концентрацию ионов водорода через х, тогда концентрация формиат-ионов будет равна (х+0,1), а неионизированных молекул муравьиной кислоты (0,1–х).
Подставляем значения в формулу КНСООН:
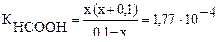
асчет можно упростить, принимая во внимание, что значение х по сравнению с 0,1 мало и им можно пренебречь.
Тогда получим:
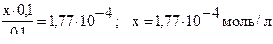
3) Рассчитываем, во сколько раз изменилась концентрация ионов Н+:
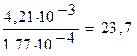
Ответ: концентрация ионов Н+ уменьшилась в 23,7 раза.
Контрольные вопросы и задания
1. Что такое растворы? Характеристика составных частей растворов?
2. Каков механизм образования растворов?
а)отделение молекул от поверхностей
б)диффузия молекул
в)образование сольватов
3. Электролиты и неэлектролиты. Определение и примеры.
4. Что такое электролитическая диссоциация?
5. Степень электролитической диссоциации; факторы, влияющие на степень диссоциации. Сильные, средние и слабые электролиты. Определение и примеры.
6. Опишите равновесие в растворах слабых электролитов. Формулы константы диссоциации слабой кислоты и слабого основания(константа кислотности, константа основности). Факторы, влияющие на величину константы диссоциации.
7. Покажите связь между константой диссоциации и степенью диссоциации (закон разбавления Освальда).
8. Охарактеризуйте ступенчатый характер ионизации.
9. Перечислите теории кислот и оснований:
а)теория Аррениуса
б)теория Бренстеда и Лоури
в)теория Льюиса
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 83 – 88 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 255 – 257 с.
2. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 41 – 53 с.
Задания для самостоятельного решения
1. Определить константу ионизации уксусной кислоты СН3СООН, если степень ионизации 0,12м. раствора ее равна 1,21%.
Ответ: 1,75·10-5.
2. Определить степень ионизации азотистой кислоты НNО2, если концентрация раствора ее 0,12м. и Кион = 6,90·10-4.
Ответ: 7,6%.
3. Определить степень ионизации (αион) гидроксида аммония, если концентрация раствора равна 0,1м, Кион = 1,74·10-5
Ответ: 1,33%.
4. Концентрация ионов водорода [Н+] и ацетат-ионов [СН3СОО-] равна 0,00132 моль/л. Вычислить константу ионизации, если раствор 0,1м.
Ответ: 1,74·10-5.
5. Степень ионизации (αион) 0,14м. раствора муравьиной кислоты НСООН равна 4,24%. Вычислить константу ионизации этой кислоты.
Ответ: 2,6·10-4.
6. Определить константу ионизации уксусной кислоты СН3СООН, если степень ионизации ее в 0,2м. растворе равна 0,932%.
Ответ: 1,74·10-5.
7. Чему равна концентрация ацетат-ионов [СН3СОО-] в 0,001м. растворе уксусной кислоты, Кион = 1,74·10-5 ,если степень ионизации равна 13,2%?
Ответ: 1,32·10-4моль/л.
8. Вычислить степень и константу ионизации 1,028м. водного раствора гидроксида аммония NH4OH. Концентрация ионов гидроксида [ОН-] в нем равна 0,00426моль/л.
Ответ: 0,00413 или 0,413%, К=1,76·10-5
9. Определить и сопоставить концентрации ионов водорода [Н+] в растворах 0,1м. НСl и 0,1м. уксусной кислоты, Кион укс = 1,74·10-5 , Кион HCl= 1·107
Ответ: 0,1моль/л; 1,32·10-3моль/л.
10. Вычислить концентрацию ионов водорода [Н+] 6%-ного раствора хлороводородной кислоты, r=0,8г/мл.
Ответ: 1,32моль/л.
11. Какова концентрация гидроксид-иона [ОН-] в 5%-ном растворе уксусной кислоты, Кион = 1,74·10-5, r=1г/мл?
Ответ: 2,66·10-12моль/л.
12. Определить концентрацию ионов водорода [Н+] в 0,2м. растворе муравьиной кислоты НСООН, если αион = 3%.
Ответ: 6·10-3моль/л.
13. Константа ионизации уксусной кислоты равна 1,74·10-5, степень ионизации равна 1,36%. Вычислить молярную концентрацию.
Ответ: ~ 0,1м.
14. Определить концентрацию ионов водорода [Н+] в 0,012м. растворе бензойной кислоты (Кион С6Н5СООН = 6,3·10-5).
Ответ: ~ 8,7·10-4моль/л.
15. Вычислить концентрацию ацетат-ионов [СН3СОО-] в 0,001м. растворе уксусной кислоты, Кион = 1,74·10-5
Ответ: 1,32·10-4моль/л.
16. Вычислить степень ионизации муравьиной кислоты в 0,48м. растворе ее, если [Н+] = 0,01моль/л.
Ответ: 0,02 или 2%.
17. Рассчитать, как изменится степень ионизации 0,2м. водного раствора уксусной кислоты, если его разбавить в 2 раза, Кион = 1,74·10-5
Ответ: увеличивается в 1,4 раза.
18. Вычислить, как изменится степень ионизации αион 0,15н. раствора муравьиной кислоты при разбавлении в 3 раза, Кион = 1,8·10-4
Ответ: увеличится в 1,73 раза.
19. 0,1м. раствор цианистоводородной кислоты разбавили в 10 раз. Как изменилась при этом степень ионизации? Кион = 7,9·10-10
Ответ: увеличится в 3,16 раза.
20. Вычислить степень ионизации 0,22н. раствора муравьиной кислоты, в 500мл которого растворили 3,4г формиата натрия НСООNa, Кион = 1,8·10-4
Ответ: 0,18%.
ЗАНЯТИЕ 13
Дата: 2018-12-21, просмотров: 1443.