В основе МВС лежит предположение о том, что при образовании молекулы атомы сохраняют свою электронную конфигурацию. Силы, связывающие атомы, обусловлены обменом электронов между атомами.
Основные положения образования химической связи основанной на МВС:
1. связь образуется при взаимодействии атомов с неспаренными электронами.
2. химическую связь образуют атомы, электроны которых обладают антипараллельными спинами.
3. при возникновении химической связи образуется общая электронная пара, т.е. связь имеет двухэлектронный характер.
4. число общих электронных пара определяет валентность элементов, образующих химическую связь.
5. связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака
Механизм образования ковалентной связи
В методе ВС различают обменный и донорно - акцепторный механизм образования ковалентной связи.
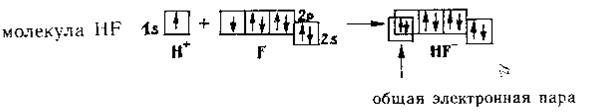
При обменном механизме – химическая связь образуется за счет неспаренных электронов атома. В этом механизме образования связи могут участвовать s, p, d – электроны.
Например:
Примером образования молекул по донорно – акцепторному механизму является образование иона аммония (NH4+). У атома азота в молекуле аммиака три р – орбитали, образующие связь с Н по обменному механизму. Одна s – орбиталь занята неподеленной электронной парой. Ион водорода имеет одну вакантную (свободную) орбиталь. Химическая связь возникает благодаря тому, что неподеленная пара электронов атома азота занимает вакантную орбиталь иона водорода. Таким образом появляется общая электронная пара.
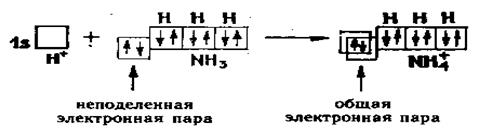
Частица, представляющая неподеленную электронную пару, называется донором, а вакантную орбиталь – акцептором. Этот механизм образования называют донорно – акцепторным.
Контрольные вопросы и задания
1. Дайте определения следующим понятиям: химическая связь, ковалентная связь, молекула, молекулярный ион, длина связи, энергия связи; энергия ионизации, энергия сродства к электрону, относительная электроотрицательность атома, валентный угол.
2. Перечислите основные положения образования химической связи основанной на МВС.
3. Опишите механизм образования ковалентной связи (обменный и донорно-акцепторный механизм).
4. Как образуются сигма и пи связи при перекрывании s, p и d –орбиталей?
5. Приведите характеристики ковалентной связи: кратность, насыщаемость, направленность (гибридизация атомных орбиталей), полярность, поляризуемость.
6. Какие недостатки МВС?
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 63 – 68 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 35 – 45 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 77 – 96 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. - 17 – 24 с.
Задания для самостоятельного решения
1. В рамках метода валентных связей (МВС) составьте схему образования молекулы кислорода О2.
2. В рамках метода валентных связей (МВС) составьте схему образования молекулы хлороводорода НСl.
3. В рамках метода валентных связей (МВС) составьте схему образования молекулы фтора F2.
4. В рамках метода валентных связей (МВС) составьте схему образования молекулы водорода Н2.
5. В рамках метода валентных связей (МВС) составьте схему образования молекулы хлора Сl2.
6. В рамках метода валентных связей (МВС) составьте схему образования молекулы фтороводорода НF.
ЗАНЯТИЕ 5
Дата: 2018-12-21, просмотров: 926.