1) образует с атомами металлов нейтральные комплексы
2) практически нерастворим в H2O
3) способен взаимодействовать с О2
4) образует с гемоглобином комплекс на 2 порядка более устойчивый по сравнению с оксигемоглобином
5. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Mg2+, NH3
2) Al3+, NH3
3) Pt4+, NH3
4) Pt4+, NO3-
II . Учение о растворах
ЗАНЯТИЕ 9 - 10
Растворы. Концентрация растворов. Массовая доля. Молярная концентрация.
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Решение задач
4. Лабораторная работа 2 “Приготовление растворов заданной концентрации”
5. Контрольная работа
6. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Раствор – устойчивая гомогенная система переменного состава, состоящая из двух и более компонентов, между которыми существуют достаточно сильные взаимодействия.
Концентрация – важнейшая характеристика раствора. Она определяет содержание вещества в растворе. В зависимости от возможных вариантов выражения содержания вещества различают массовый и объемный способы выражения концентрации. К массовому способу относят массовую долю, а к объемному – молярную концентрацию и молярную концентрацию эквивалента.
Массовая доля ω(Х) – это отношение массы растворенного вещества к массе раствора:
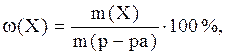
где Х – растворенное вещество;
ω(Х) – массовая доля вещества Х в растворе (массовая доля – величина безразмерная, выражается в долях от единицы или в процентах);
m(Х) – масса вещества, г;
m(р-ра) – масса раствора, г;
масса раствора связана с объемом следующим образом
m(р-ра)=V.ρ
где V – объем раствора, мл,
ρ – плотность раствора, г/мл.
m(р-ра)=m(Х)+m (H2O)
Пример 1. В 258,3 г воды растворили 41,7 г кристаллогидрата FeSO4 . 7H2O. Определить массовую долю FeSO4 в полученном растворе.
Решение.
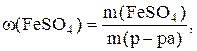
Определяем m (р-ра):
m(р-ра)=m(FeSO4.7H2O)+m(H2O)=41,7+258,3=300г.
Определяем массу FeSO4:
m(FeSO4)=n(FeSO4).M(FeSO4),
а поскольку n(FeSO4)=n(FeSO4.7H2O), то
m(FeSO4)=n(FeSO4.7H2O).M(FeSO4)= 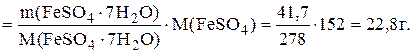
Вычисляем ω(FeSO4):
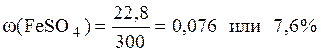
Ответ: ω(FeSO4)=0,076 или 7,6%.
Разбавление и концентрирование растворов
При решении задач, связанных с разбавлением или концентрированием растворов, следует помнить, что масса растворенного вещества остается неизменной, т.е. m(Х)=const. Изменяется только масса растворителя и, соответственно, масса раствора.
Пример 2. Какой объем воды необходимо добавить к 100 мл раствора (ρ=1,1г/мл) ω(HNO3)=20%, чтобы получить раствор HNO3, ω(HNO3)=5%?
Решение.
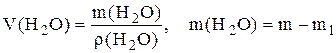
где m1 – масса исходного раствора, m – масса полученного раствора.
Масса искомого раствора определяется:
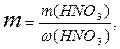
m(HNO3)= m1·ω(HNO3)=V1·ρ·ω1=100·1,1·0,2=22г.
отсюда масса раствора:
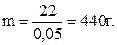
Масса добавленной воды будет равна:
m(H2O)=440-100·1,1=330г,
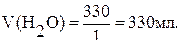
Ответ: следует добавить 330 мл Н2О.
Дата: 2018-12-21, просмотров: 732.