При разбавлении и концентрировании растворов количество вещества эквивалента остается постоянным.
Пример 9. До какого объема следует упарить 3,5л раствора H2SO4, С(1/2H2SO4)=0,04моль/л, чтобы получить раствор с концентрацией кислоты 0,2моль/л.
Решение.
Величина n(H2SO4)= n(1/2H2SO4)·1/2= С(1/2H2SO4) 1/2·V =0,04·3,5·1/2 =0,07 моль, откуда,
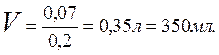
Ответ: V=350мл.
Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество вещества эквивалента в полученном растворе равно сумме количества вещества эквивалентов смешиваемых растворов:
n(Х)=n1(Х)+n2(Х)+n3(Х)+…,
где n(Х) – количество вещества в полученном растворе,
n1(Х),n2(Х),n3(Х) – количество вещества (Х) в смешиваемых растворах.
Пример 10. Смешали 3литра раствора H3PO4 (C(H3PO4)=0,1моль/л) и 2литра раствора H3PO4 (ω(H3PO4)=9%, ρ=1,05г/мл). Вычислить молярную концентрацию эквивалента полученного раствора (контракцией можно пренебречь).
Решение.
Фактор эквивалентности H3PO4=1/3:
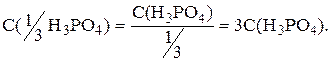
Поскольку по условию задачи контракцией пренебрегаем, то:
V=V1+V2=3,0+2,0=5,0л.
n(H3PO4)=n1(H3PO4)+n2(H3PO4),
n1(H3PO4)=С1(H3PO4)∙V1=0,1∙3=0,3моль,
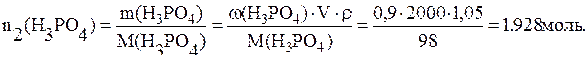
n(H3PO4)=0,3+1,928=2,258моль.
Рассчитываем 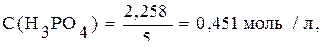
С(1/3H3PO4)=0,451∙3=1,353моль/л.
Ответ: С(1/3H3PO4)=1,353моль/л.
Пример 11. Для осаждения ионов железа (II), содержащихся в 20мл раствора FeSO4, израсходовано 30мл раствора КОН (С(КОН)=0,3моль/л). Определить молярную и молярную концентрацию эквивалента сульфата железа (II).
Решение.
Фактор эквивалентности FeSO4=1/2.
По закону эквивалентов:
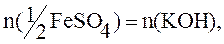
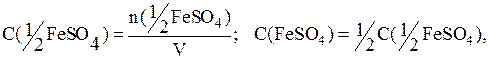
n(KOH)=C(KOH)·V=0,3·0,03=0,009моль.
Рассчитываем
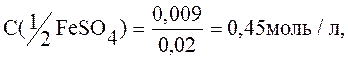
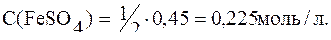
Ответ: С(1/2FeSO4)=0,45моль/л, С(FeSO4)=0,225моль/л.
Контрольные вопросы и задания
1. Что такое эквивалент? Дайте определение и запишите формулы для его расчета.
2. Как рассчитать фактор эквивалентности различных классов соединений (основания, кислоты, соли, оксидов)?
3. Как найти количества вещества эквивалента, количества вещества эквивалента элемента?
4. Как рассчитать состав вещества по закону эквивалентов?
5. Дайте определение и запишите формулы для молярной концентрации эквивалента вещества.
6. Приведите расчеты, связанные с разбавлением и концентрированием растворов.
7. Приведите расчеты, связанные со смешиванием растворов различной концентрации.
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 77 – 81 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 63 – 76 с.
2. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 41 – 44 с.
Задания для самостоятельного решения
Дата: 2018-12-21, просмотров: 713.