План занятия
1. Проверка посещаемости и информация.
2. Контрольная работа по теме «Химическая связь».
3. Подведение итогов занятия.
Пример контрольной работы
1. Составьте электронную формулу атома скандия.
2. Какому элементу соответствует приведенный фрагмент электронной формулы … 3d64s2. Составьте электронно-структурную схему данного фрагмента. Напишите полную электронную формулу этого элемента.
3. Дайте определение следующим понятиям: энергия сродства к электрону, насыщаемость ковалентной связи.
4. В рамках метода валентных связей составьте схему образования молекулы хлора.
5. В рамках метода молекулярных орбиталей составьте энергетическую диаграмму атомных и молекулярных орбиталей.
ЗАНЯТИЕ 7
Комплексные соединения
План занятия
1. Проверка посещаемости и информация
2. Устный опрос и коррекция знаний
3. Подведение итогов занятия
БЛОК ИНФОРМАЦИИ ПО ТЕМЕ
Основные положения координационной теории:
1. В большинстве к.с. различают внутреннюю и внешнюю сферы.
2. Во внутренней сфере центральное место занимает комплексообразователь - чаще всего катион металла, реже - анион или какой-либо нейтральный атом (акцептор электронных пар).
3. Комплексообразователь окружен лигандами (аддендами) - противоположно заряженными ионами или нейтральными молекулами (донорами электронных пар).
4. Число свободных орбиталей, предоставляемых комплексообразователем для неподеленных электронных пар лигандов, называется координационным числом (к.ч.) комплексообразователя.
5. Комплексообразователь и лиганды образуют внутреннюю, т.н. координационную, сферу к.с. В формулах внутренняя сфера заключается в квадратные скобки.
6. Заряд внутренней сферы к.с. равен алгебраической сумме зарядов всех частиц, образующих внутреннюю сферу к.с.
7. Ионы, не разместившиеся во внутренней сфере к.с. образует внешнюю сферу. Суммарный заряд ионов внешней сферы нейтрализует заряд внутренней сферы к.с.
K 3[Fe(CN)6] - красная кровяная соль

CN- CN-
K+ CN- лиганды
K+
Fe3- комплексообразователь
K+ CN-
CN- CN-
внешняя сфера внутренняя сфера
к.ч. ( Fe 3- ) = 6
[Fe +3 ( C N -1 )6]x
x = (+3) + 6(-1)
x = -3
Эталоны решения задач
Пример 1. Чему равно координационное число и степень окисления комплексообразователя, заряд комплексного иона в соединениях: [Zn(NH3)2]Cl2, K4[Pb(S2O3)3], K2[HgBr4]?
Решение.
[Zn(NH3)2]Cl2 - к.ч. 2, +2, +2
K4[Pb(S2O3)3] - к.ч. 3, +2, - 4
K2[HgBr4] – к.ч. 4, +2, - 2
Пример 2. Какое из двух комплексных соединений характеризуется максимальной устойчивостью, если их константы нестойкости равны: а) 10-7, б) 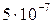 ?
?
Решение:
Чем меньше константа нестойкости, тем более устойчиво комплексное соединение.
10-7 < 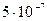 , значит, более устойчиво комплексное соединение а).
, значит, более устойчиво комплексное соединение а).
Пример 3. Раствор какого из комплексных соединений будет иметь большее осмотическое давление при равных значениях молярной концентрации:
а) [Ag(NH3)2]Cl; б) K2[Cu(CN)4] ?
Решение:
При одинаковой молярной концентрации большее осмотическое давление будет у раствора того вещества, которое при диссоциации дает большее число ионов.
 [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (2 иона из одной молекулы)
[Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- (2 иона из одной молекулы)
 K2[Cu(CN)4] 2K+ + [Cu(CN)4]2- (3 иона из одной молекулы)
K2[Cu(CN)4] 2K+ + [Cu(CN)4]2- (3 иона из одной молекулы)
Поэтому, большее осмотическое давление будет у раствора б).
Контрольные вопросы и задания
1. Дайте понятие комплексного соединения (КС).
2. Перечислите основные положения теории Вернера:
- внешняя и внутренняя сфера,
- комплексообразователь,
- лиганды,
- координационное число центрального атома.
3. Что относится к моно-, би- и полидентатные лиганды?
4. Какова природа химической связи в КС?
5. Охарактеризуйте устойчивость КС (константы нестойкости комплексов и устойчивости).
6. Какие лиганды и комплексообразователи относят к жестким и мягким?
7. Какова способность атомов различных элементов к комплексообразованию?
8. Приведите классификацию КС.
9. Как образюется КС и каковы их химические свойства?
10. Охарактеризуйте биологическую роль и применение КС.
Основная литература:
1. Жолнин А.В. Общая химия [Текст] / А.В. Жолнин. - ГЭОТАР – Медиа, 2012. – 119 – 132 c.
Дополнительная литература:
1. Пузаков, С.А. Общая химия [Текст] / Пузаков С.А., Попков В.А – М.: 2010 г. – 649 – 681 с.
2. Ахметов Н.С. Общая и неорганическая химия [Текст] / Ахметов Н.С. – М.: Химия, 2009 г., 107 – 111 с.
3. Общая химия. Теоретический курс. [Текст]: учебно-методическое пособие для студентов 1 курса фармацевтического факультета / под ред. Г.М. Зубаревой. – Тверь: : Ред.-издат. центр Твер. гос. мед. унив., 2017 г. – 33 – 40 с.
ЗАДАНИЯ В ТЕСТОВОЙ ФОРМЕ
Инструкция: Укажите один или несколько вариантов правильных ответов
1. Координационное число комплексообразователя в соединении [ Co ( NH 3 )6] Cl 3 равно(1):
1) 3
2) 4
3) 5
4) 6
2. Координационное число комплексообразователя в соединении [ Ni ( H 2 O )4] Cl 2 равно(1):
1) 2
2) 3
3) 4
4) 5
3. Координационное число комплексообразователя в соединении [ Ag ( NH 3 )2] Cl равно(1):
1) 2
2) 3
3) 4
4) 5
4. Координационное число комплексообразователя в соединении K 2 [ C о( C 2 O 4 )2] равно(1):
1) 2
2) 3
3) 4
4) 5
5. Координационное число комплексообразователя в соединении K 3 [ Al ( C 2 O 4 )3] равно(1):
1) 3
2) 4
3) 5
4) 6
6. Координационное число комплексообразователя в соединении K 3 [ Fe ( CN )5( NH 3 )] равно(1):
1) 3
2) 4
3) 5
4) 6
7. Степень окисления комплексообразователя в комплексной соли [ Pt ( NH 3 )3 Cl ] Cl равна(1):
1) +1
2) +2
3) +3
4) +4
8. Степень окисления комплексообразователя в комплексной соли K 2 [ PbJ 4 ] равна(1):
1) -1
2) 0
3) +1
4) +2
9. Степень окисления комплексообразователя в комплексной соли Na 3 [ C о( NO 2 )6] равна(1):
1) -3
2) 0
3) +2
4) +3
10. Степень окисления комплексообразователя в комплексной соли [ Co ( NH 3 )5( NO 2 )] Cl 2 равна(1):
1) 0
2) +1
3) +2
4) +3
11. Степень окисления комплексообразователя в комплексной соли K [ J ( J 2 )2] равна(1):
1) -1
2) 0
3) +1
4) +2
12. Степень окисления комплексообразователя в комплексной соли K 3 [ Fe ( CN )5( NH 3 )] равна(1):
1) -1
2) 0
3) +1
4) +2
13. Напишите уравнение реакции первичной диссоциации комплексной соли Na 3 [ C о( NO 2 )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 3
3) 6
4) 7
14. Напишите уравнение реакции первичной диссоциации комплексной соли [ Co ( NH 3 )6] Cl 3 . При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 2
3) 3
4) 6
15. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Fe ( CN )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном(1):
1) 1
2) 4
3) 6
4) 10
16. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Pb ( S 2 O 3 )3]. При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 8
2) 6
3) 4
4) 1
17. Напишите уравнение реакции первичной диссоциации комплексной соли [ Zn ( NH 3 )4] Cl 2 . При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 7
2) 6
3) 4
4) 2
18. Напишите уравнение реакции первичной диссоциации комплексной соли [ Co ( NH 3 )4] Cl 2 . При диссоциации формульной единицы должны образовываться анионы в количестве равном (1):
1) 1
2) 2
3) 4
4) 6
19. Напишите уравнение реакции вторичной диссоциации соли [ Cu ( NH 3 )4] Cl 2 и укажите выражение константы устойчивости комплексного иона(1):
1) 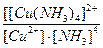
2) 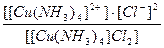
3) 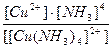
20. Напишите уравнение реакции вторичной диссоциации соли K 2 [ HgBr 4 ] и укажите выражение константы нестойкости комплексного иона(1):
1) 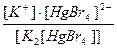
2) 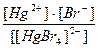
3) 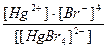
21. Напишите уравнение реакции вторичной диссоциации соли [ Cu ( NH 3 )4] SO 4 и укажите выражение константы нестойкости комплексного иона(1):
1) 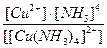
2) 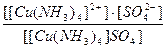
3) 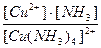
22. Напишите уравнение реакции вторичной диссоциации соли K 3 [ Fe ( CN )6] и укажите выражение константы устойчивости комплексного иона(1):
1) 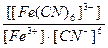
2) 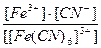
3) 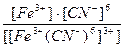
23. Напишите уравнение реакции вторичной диссоциации соли K 4 [ Fe ( CN )6] и укажите выражение константы нестойкости комплексной частицы(1):
1) 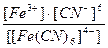
2) 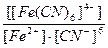
3) 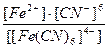
24. Напишите уравнение реакции вторичной диссоциации соли Na [ Au ( CNS )4] и укажите выражение константы нестойкости комплексной частицы(1):
1) 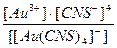
2) 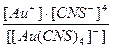
3) 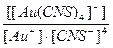
25. Из пяти комплексных соединений наименее устойчиво то, у которого константа устойчивости ( 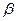 ) равна(1):
) равна(1):
1) 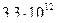
2) 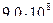
3) 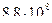
4) 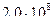
26. Из пяти комплексных соединений максимальной устойчивостью внутренней сферы обладает то, у которого константа устойчивости 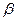 равна(1):
равна(1):
1) 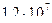
2) 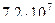
3) 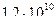
4) 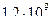
27. Из пяти комплексных соединений наименьшей устойчивостью характеризуется, то у которого константа устойчивости ( 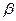 ) равна(1):
) равна(1):
1) 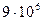
2) 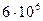
3) 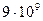
4) 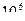
28. Из пяти комплексных соединений наименее устойчиво, то у которого константа нестойкости КН равна(1):
1) 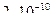
2) 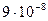
3) 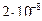
4) 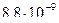
29. Из пяти комплексных соединений наиболее устойчиво, то у которого константа нестойкости КН равна(1):
1) 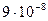
2) 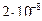
3) 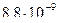
4) 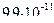
30. Максимально возможная дентатность аминокислоты глицина
H 2 N - CH 2 - COOH в качестве лиганда равна(1):
1) 1
2) 2
3) 3
4) 4
31. 







 Максимальная дентатность ЭДТА равна(1):
Максимальная дентатность ЭДТА равна(1):
HOOC CН2 N CH2 CH2 N CH2 COOH

 HOOC CH2 CH2 COOH
HOOC CH2 CH2 COOH
1) 3
2) 4
3) 5
4) 6
32. Максимальная дентатность аминокислоты лизина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
 (CH2)4
(CH2)4
NH2
1) 1
2) 2
3) 3
4) 4
33.  Определите максимально возможную дентатность аспарагиновой кислоты в качестве лиганда HOOC― CH ―CH2 ―COOH (1):
Определите максимально возможную дентатность аспарагиновой кислоты в качестве лиганда HOOC― CH ―CH2 ―COOH (1):
NH2
1) 1
2) 2
3) 3
4) 4
34. Максимальная дентатность аминокислоты аланина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
CH3
1) 1
2) 2
3) 3
5) 4
35. Максимальная дентатность аминокислоты цистеина


 H2N CH COOH в качестве лиганда равна(1):
H2N CH COOH в качестве лиганда равна(1):
 CH2
CH2
SH
1) 1
2) 2
3) 3
4) 4
36. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Ca2+, NH3
2) Ca2+, H2O
3) Cu2+, H2O
4) Cu2+, NH3
37. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Mg2+, NH3
2) Al3+, NH3
3) Pt4+, NH3
4) Pt4+, NO3-
38. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Pb2+, OH-
2) Pb4+, NO3-
3) Zn2+, OH-
4) Zn2+, CN-
39. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Cu2+, CH3 - NH2
2) Cu2+, Cl-
3) Cu2+, H2O
4) Al3+, NH3
40. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц(1):
1) Na+, NH3
2) Li+, CN-
3) Ca2+, H2O
4) Co2+, NH3
41. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах частиц (1):
1) Hg2+, J-
2) Hg2+, NO3
3) Hg2+, Cl-
4) Cd2+, H2O
42. Процесс умягчения воды с помощью трилона Б описывают уравнения(2):
1) 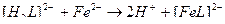
2) 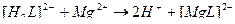
3) 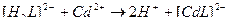
4) 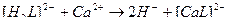
43. Наиболее устойчивые комплексные ионы образуются при взаимодействии в водных растворах следующих веществ(2):
1) 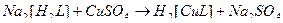
2) 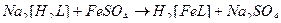
3) 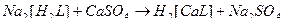
4) 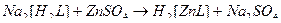
44. Наиболее устойчивые комплексные ионы образуются в результате процессов проходящих в водных растворах(2):
1) 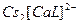 ↔
↔ 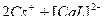
2) 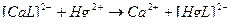
3) 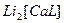 ↔
↔ 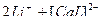


4) 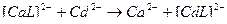
45. Наиболее устойчивые комплексные ионы образуются в результате процессов проходящих в водных растворах(2):
1) 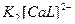 ↔
↔ 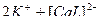
2) 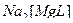 ↔
↔ 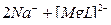


3) 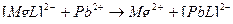


4) 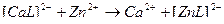
46. Высокая токсичность цианидов для человека и животных объясняется(2):
1) их хорошей растворимостью в биологических жидкостях
2) малой распространенностью в живой природе
3) способностью вытеснять из комплексных соединений более жесткие лиганды
4) ингибированием фермента цитохромоксидазы
47. В состав комплексных соединений хелатного типа могут входить лиганды(2):
1) СО-
2) NH2 – CH2 – COOH
3) NH3
4) NH2 – CH2 – CH2 – CH2 – NH2
48. Токсичность угарного газа для организма человека и животных можно объяснить тем, что СО(1):
1) образует с атомами металлов нейтральные комплексы
2) практически нерастворим в H2O
3) способен взаимодействовать с О2
4) образует с гемоглобином комплекс на 2 порядка более устойчивый по сравнению с оксигемоглобином
49. Токсическое действие нитратов на организмы человека и животных можно объяснить тем, что под их воздействием(1):
1) происходит окисление белка глобина
2) разрушается железо – порфириновый комплекс
3) изменяется координационное число катиона железа
4) гемоглобин превращается в метгемоглобин
50. В состав зеленого пигмента растений хлорофилла входит(1):
1) свободный катион Fe2+
2) свободный катион Mg2+
3) железо – порфириновый комплекс
4) магний – порфириновый комплекс
51. В состав дыхательных ферментов цитохромоксидаз входят комплексы, содержащие(1):
1) Fe3+, Cu2+
2) Co3+, Fe2+
3) Mg2+, Zn2+
4) Fe3+, Pb2+
52. Сложный белок метгемоглобин(3):
1) не способен к переносу к О2
2) взаимодействует с СО2
3) образуется из гемоглобина при окислении Fe2+ в составе гема до Fe3+
4) в норме в организме отсутствует
53. Сложный белок крови гемоглобин(2):
1) содержит магний – порфириновый комплекс
2) содержит в составе железо – порфиринового комплекса Fe2+
3) содержит в составе железо – порфиринового комплекса Fe3+
4) в капиллярах легких превращается в оксигемоглобин
ЗАНЯТИЕ 8
Комплексные соединения
План занятия
1. Проверка посещаемости и информация
2. Контрольная работа по теме «Комплексные соединения»
3. Лабораторная работа 1. «Комплексные соединения и их свойства»
4. Подведение итогов занятия
Пример контрольной работы
1. Координационное число комплексообразователя в соединении [ Ni ( H 2 O )4] Cl 2 равно
1) 2
2) 3
3) 4
4) 5
2. Степень окисления комплексообразователя в комплексной соли K [ J ( J 2 )2] равна
1) -1
2) 0
3) +1
4) +2
3. Напишите уравнение реакции первичной диссоциации комплексной соли K 4 [ Fe ( CN )6]. При диссоциации формульной единицы должны образовываться анионы в количестве равном
1) 1
2) 4
3) 6
4) 10
Дата: 2018-12-21, просмотров: 827.