2NO + O2 = 2NO2
Получение азотной кислоты
При взаимодействии оксида азота (IV) с водой имеет место диспропорционирование азота в степени окисления +4 в N+3 и N+5 с образованием азотистой и азотной кислот соответственно.
2NO2+H2O→HNO2+HNO3
Получение нитрата меди ( II ) из азотной кислоты
Это соединение можно получить прямым взаимодействием меди с концентрированной азотной кислотой. Следует помнить, что при этом образуется, кроме соли, еще вода и оксид азота (IV).
Cu+4HNO3 конц.→Cu(NO3)2+NO2+2H2O
Получение гидроксида меди ( II ) из нитрата меди ( II )
Гидроксид получают взаимодействием соли со щелочью. В таблице растворимости имеется информация, что гидроксид меди (II) нерастворим.
Молекулярное уравнение:
Cu(NO3)2+2NaOH→Cu(OH)2¯+2NaNO3
Полное ионное уравнение получаем, зная, что соли (нитрат меди, нитрат натрия) и основание (гидроксид натрия) являются сильными электролитами и в растворе находятся в виде ионов:
Cu2++2NO3ˉ+2Na+ +2OHˉ→Cu(OH)2 ¯+2Na+ +2NO3ˉ
К образованию осадка Cu ( OH )2, выпадение которого указали стрелкой. направленной вниз, привело соединение ионов меди Cu 2+ с гидроксид-ионами OH -. В полном ионном уравнении их подчеркнули. К этому же уравнению придем, если сократим одинаковые ионы в левой и правой частях уравнения.
Сокращенное ионное уравнение:
Cu2+ +2OHˉ→Cu(OH)2¯
Получение оксида меди( II ) из гидроксида меди ( II )
Известно, что при нагревании нерастворимые гидроксиды теряют воду, и превращаются в соответствующие оксиды. Это один из способов получения оксидов: Сu(OH)2 ® CuO + H2O.
Получение меди из оксида
Этот процесс возможен в результате восстановления, например, водородом.
CuO+H2→Cu+H2O
Задача 2. Укажите формулы по названиям: а) дигидроарсенат калия, б) хлорид гидроксоалюминия, в) сульфид хрома(III).
Решение : а) дигидроарсенат калия − кислая соль мышьяковой кислоты − H3AsO4, в которой лишь один ион водорода заместился на металл, следовательно, формула требуемой в условии соли − KH2AsO4;
б) хлорид гидроксоалюминия – основная соль, в которой из трех гидроксогрупп гидроксида алюминия Al(OH)3 незамещенной осталась одна, т.е. формула требуемого соединения – AlOHCl2;
в) сульфид хрома(III) – это Cr2S3. Ответ на этот вопрос получаем, используя знания классов неорганических веществ и номенклатуры для них.
Задача 3. Укажите формулы оксидов для указанных гидроксидов: а) Al(OH)3, б) H2SO4
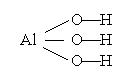
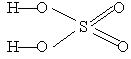
Решение : Чтобы получить формулы оксидов для гидроксидов Al ( OH )3 и H 2 SO 4, структурные формулы которых
|  , ,
|
можно:
а) удалить воду;
б) определить заряд элемента, образовавшего указанный гидроксид, и составить формулу оксида для этого элемента с установленным зарядом.
a) провести формальное обезвоживание:
| (-H2O) |
| для Al(OH)3 → Al2O3 ; |
| (-H2O) |
| для H2SO4 → SO3 ; |
б) Al+32O2-3 ; S+6O23
Структурные формулы заданных оксидов:
| O=Al¾O¾Al=O | 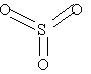
|
Задача 4. Напишите уравнения реакций с образованием указанных продуктов: Al(OH)3 + HCl = (средняя, основные соли).
Решение : При взаимодействии основания с кислотой получается соль и вода. При неполном замещении гидроксогруппп многокислотных оснований получаются основные соли, например:
1) Al(OH)3+НСl→Al(OH)2Cl+H2O – заместилась одна гидроксогруппа;
2) Al(OH)3+2НСl→AlOHCl2+2H2O – заместились две гидроксогруппы;
3) Al(OH)3+3НСl→AlCl3+3H2O – заместились все три гидроксогруппы.
Задача 5. Напишите полное ионное и молекулярное уравнения по ионному Cr3+ + S2- = Cr2S3.
Решение : Согласно алгоритму подбираем, используя таблицу растворимости, противоионы к катиону Cr+3 к аниону S-2, чтобы соединения из молекул составленных частиц были растворимы и хорошо диссоциировали в растворе. По последней причине не подойдет H2S.
Возможное полное ионное уравнение для заданного ионного:
2Cr3+ +6Сlˉ +6Na+ +3S2ˉ →Cr2S3 ↓+6Na+ +6Сlˉ .
Молекулярное уравнение:
2CrСl3+3Na2S→Cr2S3↓+6NaCl..
Задание 2 по теме «Классы неорганических веществ»
Дата: 2018-11-18, просмотров: 792.