Основные виды коррозии. Химическая коррозия. Электрохимическая коррозия. Коррозия под действием блуждающих токов. Метод защиты от коррозии: легирование, электрохимическая защита, защитные покрытия. Изменение свойств коррозионной среды. Ингибиторы коррозии [1, 130-136, 159- 169; 2, 311-320].
Раздел 5. ОРГАНИЧЕСКИЕ ПОЛИМЕРНЫЕ МАТЕРИАЛЫ
Строение, свойства, применение полимеров в электротехнической отрасли [1, 419-466].
Лабораторный практикум
| Наименование работ | Количество часов | |
| 1 | Химическая кинетика и равновесие | 2 |
| 2 | Реакции в растворах электролитов | 4 |
| 3 | Электролиз растворов солей | 2 |
| 4 | ЭДС гальванического элемента. Коррозия металлов и защита от коррозии | 4 |
Раздел 1. ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Стехиометрические расчеты
Расчеты с использованием количества вещества
Количество вещества (ν) – это число структурных элементов (атомов, молекул, ионов, электронов и др.) в системе. Единицей измерения количества вещества является моль.
Моль – количество вещества, которое содержит столько определенных структурных элементов (молекул, атомов, ионов и т.д.), сколько содержится в 0,012 кг изотопа углерода 12С.
Число частиц, содержащихся в одном моле любого вещества, называется числом Авогадро , оно равно 6,02×1023. Физико-химическая константа, отвечающая этому числу, называется постоянной Авогадро:
NA = 6,02×1023 частиц/моль.
Массу одного моля вещества называют молярной массой (М ). Основной единицей измерения молярной массы является кг/моль или г/моль. Например, молярная масса аммиака М(NH3) = 17 г/моль, молярная масса М(H2SO4) = 98 г/моль, молярная масса калия М(К) = 39 г/моль.
Вместо молярной массы часто пользуются величиной относительной молекулярной массы. Она численно совпадает с величиной молярной массы, выраженной в г/моль.
Относительная молекулярная масса М r – это молекулярная масса соединения, отнесенная к 1/12 молярной массы изотопа углерода 12С, т.е. к одной атомной единице массы (а.е.м.), например, Mr(НNО3) = 63, Mr(NH3) = 17, Относительная молекулярная масса – величина безразмерная.
Относительная атомная масса Аr – это молярная масса атома вещества, отнесенная к 1/12 молярной массы изотопа углерода 12С. Например, относительная атомная масса калия равна Mr(К) = 39.
Молярный объем газа VM – это объем, который занимает в н.у. 1 моль газа. Молярный объем любого газа при нормальных условиях равен 22,4 л.
Алгоритм решения задач
1. Записать условие.
2. Рассчитать количество вещества, о котором речь идет в условии задачи ν (в-ва по условию), т.е. данные условия перевести в число моль вещества, используя основные формулы.
3. Выразить количество вещества, о котором речь идет в вопросе, через рассчитанную величину, т.е. осуществить переход: от ν (в-ва по условию) к ν (в-ва в вопросе), используя индексы в формуле, если задача на расчет по формуле, или коэффициенты в уравнении, если задача на расчет по уравнению.
4. Ответить на вопрос задачи, вычислив требуемую величину, например, массу, объем, выход и т.п., используя производные формулы.
Задача 1. Определите количество и массу вещества натрия, бора и кислорода, которые содержатся в образце буры Na2В4О7 массой 40,4 г.
| Дано: m(Na2В4О7) = 40,4 г | Решение |
| m(Na) − ? m(B) − ? m(O) − ? | 1. Определим количество вещества буры – n (Na2В4О7) = n (в-ва по усл), т.е. данное количество переведем в число моль вещества. |
| М(Na) = 23 г/моль М(Na) = 23 г/моль М(О) = 16 г/моль М(Na2В4О7) = 202 г/моль | Для нахождения n используем одну из основных формул
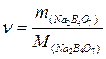 = = 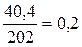 моль.
2. Выразим количество вещества, о котором речь идет в вопросе, сначала количество вещества натрия через рассчитанную величину, затем бора и, наконец, кисло-рода, т.е. осуществим переход: от моль.
2. Выразим количество вещества, о котором речь идет в вопросе, сначала количество вещества натрия через рассчитанную величину, затем бора и, наконец, кисло-рода, т.е. осуществим переход: от 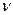 (в-ва по усл.) к (в-ва по усл.) к 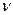 (в-ва в вопросе.), учитывая индексы в формуле. Т.е. выра-
жаем n (в-ва натрия) через n (в-ва по условию т.е. буры):
n (Na) = 2n (Na2В4О7),
так как в одну молекулу буры входит два атома натрия.
n (Na) = 2n (Na2В4О7) = 2 × 0,2 = 0,4 моль.
n (B) = 4n (Na2В4О7),
так как в одну молекулу буры входит четыре атома бора.
n (B) = 4n (Na2В4О7 ) = 4 × 0,2 = 0,8 моль.
n (O) = 7n (Na2В4О7),
так как в одну молекулу буры входит семь атомов кислорода.
n (O) = 7n (Na2В4О7) = 7 × 0,2 = 1,4 моль.
3. Ответим на вопрос задачи, определив массы натрия, бора и кислорода, используя производную формулу
m = ν∙М;
m(Na) = n(Na)×M(Na) = 0,4×23 = 9,2 г;
m (B) = n(B)×M (B) = 0,8×11 = 8,8 г;
m(O) = n(O)×M(O) = 1,4×16 = 22,4 г. (в-ва в вопросе.), учитывая индексы в формуле. Т.е. выра-
жаем n (в-ва натрия) через n (в-ва по условию т.е. буры):
n (Na) = 2n (Na2В4О7),
так как в одну молекулу буры входит два атома натрия.
n (Na) = 2n (Na2В4О7) = 2 × 0,2 = 0,4 моль.
n (B) = 4n (Na2В4О7),
так как в одну молекулу буры входит четыре атома бора.
n (B) = 4n (Na2В4О7 ) = 4 × 0,2 = 0,8 моль.
n (O) = 7n (Na2В4О7),
так как в одну молекулу буры входит семь атомов кислорода.
n (O) = 7n (Na2В4О7) = 7 × 0,2 = 1,4 моль.
3. Ответим на вопрос задачи, определив массы натрия, бора и кислорода, используя производную формулу
m = ν∙М;
m(Na) = n(Na)×M(Na) = 0,4×23 = 9,2 г;
m (B) = n(B)×M (B) = 0,8×11 = 8,8 г;
m(O) = n(O)×M(O) = 1,4×16 = 22,4 г.
|
Ответ: 9,2 г натрия, 8,8 г бора, 22,4 г кислорода.
Задача 2. Рассчитайте объем при нормальных условиях и число молекул для 4,4 г диоксида углерода. Определите массу кислорода в этой массе диоксида.
| Дано: m (CO2) = 4,4 г | Решение |
| V(CO2) − ? N(CO2) − ? | 1. Определим количество вещества диоксида углерода –
n (СО2) = 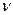 (в-ва по усл),
т.е. данные условия переведем в число моль вещества. (в-ва по усл),
т.е. данные условия переведем в число моль вещества.
|
| М(CO2)=44 г/моль М(О)=16 г/моль | Для нахождения n используем одну из основных формул
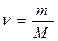 = = 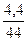 = 0,1 моль.
2. Для нахождения объема используем производную формулу
V = ν∙ V M.
Проводим расчет
V = ν∙VM = 0,1×22,4 = 2,24 л.
3. Для нахождения числа молекул также используем производную формулу
N = ν∙NA.
Проводим расчет:
N = ν∙NA = 0.1×6,02×1023 = 6,02×1022 молекул.
4. При расчете массы кислорода выразим количество вещества кислорода через количество вещества диоксида углерода:
n (O) = 2n (СО2),
так как в одну молекулу диоксида входит два атомa кислорода.
Отсюда
n (O) = 2n (СО2) = 2×0,1 = 0,2 моль.
Ответим на вопрос задачи, определив массу кислорода, используя производную формулу
m = ν∙M.
m(O) = n(O)×M(O) = 0,2×16 = 3,2 г. = 0,1 моль.
2. Для нахождения объема используем производную формулу
V = ν∙ V M.
Проводим расчет
V = ν∙VM = 0,1×22,4 = 2,24 л.
3. Для нахождения числа молекул также используем производную формулу
N = ν∙NA.
Проводим расчет:
N = ν∙NA = 0.1×6,02×1023 = 6,02×1022 молекул.
4. При расчете массы кислорода выразим количество вещества кислорода через количество вещества диоксида углерода:
n (O) = 2n (СО2),
так как в одну молекулу диоксида входит два атомa кислорода.
Отсюда
n (O) = 2n (СО2) = 2×0,1 = 0,2 моль.
Ответим на вопрос задачи, определив массу кислорода, используя производную формулу
m = ν∙M.
m(O) = n(O)×M(O) = 0,2×16 = 3,2 г.
|
Ответ: 1,24 л, 6,02×1022 молекул, 3,2 г.
Задание 1 по теме «Стехиометрические расчеты»
Дата: 2018-11-18, просмотров: 655.