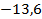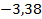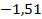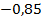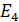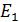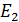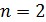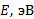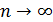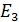Используя уравнение (1) динамики движения электрона в атоме и формулу (2) первого постулата, Бор получил выражение для радиуса 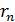
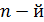 стационарной орбиты (см. решение задачи 30) в следующем виде:
стационарной орбиты (см. решение задачи 30) в следующем виде:
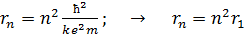 , (4)
, (4)
где 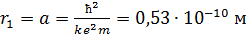 – первый боровский радиус.
– первый боровский радиус.
Формула (4) показывает, что радиусы орбит увеличиваются с ростом квантового числа 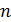 пропорционально его квадрату
пропорционально его квадрату 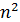 .
.
Полная энергия 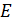 электрона в атоме водорода (и в любом другом атоме) равна сумме кинетической энергии
электрона в атоме водорода (и в любом другом атоме) равна сумме кинетической энергии 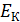 электрона и потенциальной энергии
электрона и потенциальной энергии 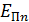 его взаимодействия с зарядом ядра (в атоме водорода
его взаимодействия с зарядом ядра (в атоме водорода 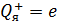 ):
):
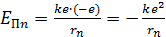 .
.
Таким образом, величина полной энергии атома водорода в состоянии с главным квантовым числом 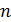
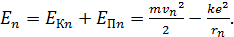 (5)
(5)
Здесь 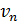 – скорость электрона на
– скорость электрона на 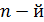 стационарной орбите, она определяется законом динамики (1);
стационарной орбите, она определяется законом динамики (1); 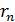 – радиус этой орбиты (см. формулу (4)). Расчет энергии атома водорода по формуле (5) (см. решение задачи 32) приводит к следующему результату:
– радиус этой орбиты (см. формулу (4)). Расчет энергии атома водорода по формуле (5) (см. решение задачи 32) приводит к следующему результату:
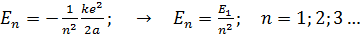 . (6)
. (6)
Здесь 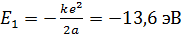 – энергия атома водорода в основном состоянии – с квантовым числом
– энергия атома водорода в основном состоянии – с квантовым числом 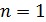 . Состояния атома с энергиями
. Состояния атома с энергиями 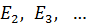 , называют возбужденными. Величина
, называют возбужденными. Величина  является минимальной энергией атома водорода. Максимальная энергия:
является минимальной энергией атома водорода. Максимальная энергия: 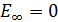 , –соответствует ионизации атома путем отрыва электрона от ядра.
, –соответствует ионизации атома путем отрыва электрона от ядра.
Полная энергия атома водорода, согласно формуле (6), отрицательна; это означает, что электрон находится в связанном состоянии. Расчет по формуле (6), где 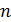 – целые числа, дает дискретный набор значений энергии атома, которые называют энергетические уровни. Схема энергетических уровней атома водорода и переходы с излучением энергии показаны на рис. 49. Эти переходы атома из одного состояния в другое
– целые числа, дает дискретный набор значений энергии атома, которые называют энергетические уровни. Схема энергетических уровней атома водорода и переходы с излучением энергии показаны на рис. 49. Эти переходы атома из одного состояния в другое
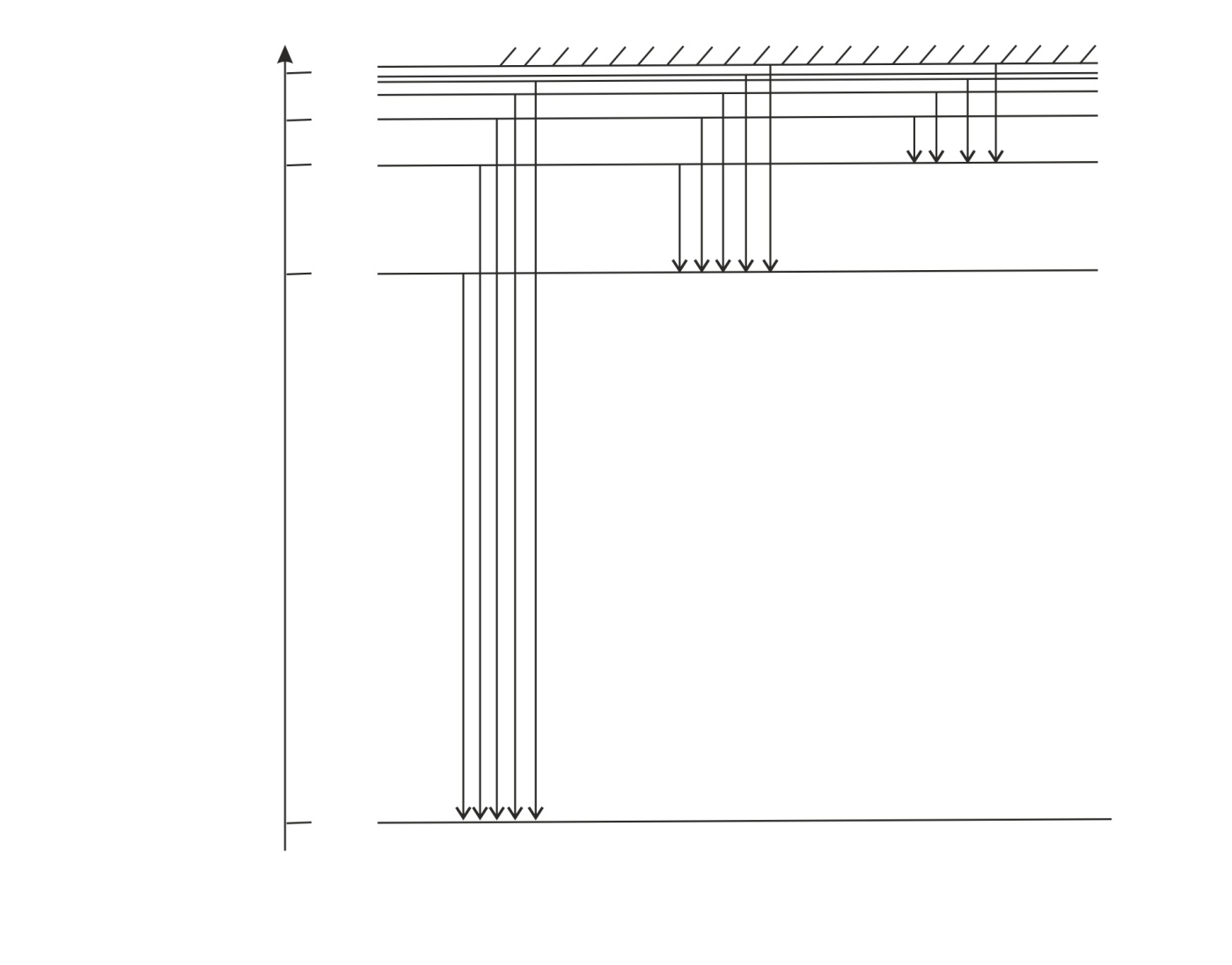
Рис. 49 |
изображены вертикальными линиями, а направление перехода показано стрелкой. Атом переходит в возбужденное состояние при соударении с другим атомом, с заряженной частицей или при поглощении фотона. Время жизни атома в возбужденном состоянии порядка 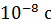 . Затем атом самопроизвольно переходит в основное состояние, излучая квант энергии.
. Затем атом самопроизвольно переходит в основное состояние, излучая квант энергии.
Частота 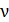 и длина волны
и длина волны 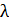 излучаемых фотонов определяются вторым постулатом Бора, который, с учетом формулы (6) для энергии атома, запишем в следующем виде:
излучаемых фотонов определяются вторым постулатом Бора, который, с учетом формулы (6) для энергии атома, запишем в следующем виде:
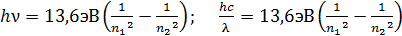 . (7)
. (7)
Формула (7) совпадает с сериальной формулой, полученной ранее экспериментально:
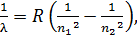 (8)
(8)
где 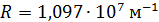 – постоянная Ридберга;
– постоянная Ридберга; 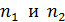 – квантовые числа стационарных состояний, причем
– квантовые числа стационарных состояний, причем 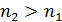 .
.
По формулам (7) и (8) можно вычислить длины волн спектральных линий всех серий в спектре излучения атома водорода: серия Лаймана ( 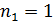 ) принадлежит ультрафиолетовой области спектра; серия Бальмера (
) принадлежит ультрафиолетовой области спектра; серия Бальмера ( 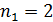 ) – видимой области; серия Пашена (
) – видимой области; серия Пашена ( 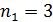 ) и последующие серии (
) и последующие серии ( 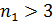 ) – инфракрасной области спектра.
) – инфракрасной области спектра.
Элементы квантовой механики
Дата: 2018-11-18, просмотров: 781.