3.1 Ковалентная связь и её характеристики. Механизмы образования ковалентной связи
Объяснение природы химической связи опирается на учение о строении атома. У атома на внешнем энергетическом уровне может содержаться от одного до восьми электронов. Внешние уровни атомов (кроме атомов инертных газов) завершаются в процессе химического взаимодействия. При этом образование молекул из атомов приводит к выигрышу энергии, так как молекулярное состояние более устойчиво, чем атомное (рис. 4). Еисх – энергетический запас взаимодействующих атомов в исходном состоянии. Основным условием образования химической связи является уменьшение энергетического запаса системы (молекулы), то количество энергии, которое выделяется при этом, называется энергией химической связи.
 Сближение атомов Сближение атомов
|
| Е |
| Еисх |
| Н-Н |
| Н + Н |
| Межъядерное расстояние (R) |
| 0,74 Å |
| Рис. 5. Кривая изменения потенциальной энергии при взаимодействии двух атомов водорода с антипараллельными спинами |
1) обменный механизм – в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из взаимодействующих атомов предоставляет в общее пользование по одному электрону. Химическая связь возникает при сближении атомов, имеющих валентные неспаренные электроны с антипараллельно направленными спинами. При достижении минимального значения потенциональной энергии системы, взаимодействующих атомов (рис. 5) формируется из двух одноэлектронных атомный облаков двуэлектронное молекулярное облако (МО), по схеме: H 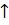 + H
+ H 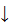 = H
= H 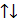 H (H-H) . Эта новая оболочка (МО) содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки, что переводит систему в энергетически более устойчивое состояние, причем, при взаимодействии 2-х атомных орбиталей с одинаковой энергией возникает две МО, но с разными энергиями, т.е. идет расщепление энергетических уровней исходных АО. Наибольшее перекрывание электронных облаков наблюдается вдоль линии связывания атомов, т.е. на линии ядер. Химическая связь тем прочнее, чем больше область перекрывания электронных орбиталей. Соединения с ковалентной связью называют гомеополярными, или атомными. Эта связь является двуэлектронной и двуцентровой. Если между двумя атомами одно двуэлектронное облако химической связи, то связь называют одинарной или простой. Если между двумя атомами два или три двуэлектронных облака химической связи, то такие связи называют кратными: (Н ─ Н) – простая; (O=O) (N
H (H-H) . Эта новая оболочка (МО) содержит по возможности завершенное число электронов и заменяет атомам их собственные незавершенные атомные оболочки, что переводит систему в энергетически более устойчивое состояние, причем, при взаимодействии 2-х атомных орбиталей с одинаковой энергией возникает две МО, но с разными энергиями, т.е. идет расщепление энергетических уровней исходных АО. Наибольшее перекрывание электронных облаков наблюдается вдоль линии связывания атомов, т.е. на линии ядер. Химическая связь тем прочнее, чем больше область перекрывания электронных орбиталей. Соединения с ковалентной связью называют гомеополярными, или атомными. Эта связь является двуэлектронной и двуцентровой. Если между двумя атомами одно двуэлектронное облако химической связи, то связь называют одинарной или простой. Если между двумя атомами два или три двуэлектронных облака химической связи, то такие связи называют кратными: (Н ─ Н) – простая; (O=O) (N  N
N  (O=S=O) – кратные связи.
(O=S=O) – кратные связи.
II . Донорно-акцепторный механизм
При донорно-акцепторном механизме химическая связь возникает за счет двуэлектронного облака одной частицы (донора) и вакантной орбитали другой частицы (акцептора), связь называется донорно-акцепторной или координационной связью: H3N  + □ H+
+ □ H+ 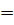 [NH4]+ . В этом примере молекула аммиака является донором электронной пары, а катион водорода выступает в роли акцептора (содержит свободную орбиталь), при этом образуется катион аммония, в котором все четыре связи N - H, независимо от происхождения являются равноценными по характеристикам.
[NH4]+ . В этом примере молекула аммиака является донором электронной пары, а катион водорода выступает в роли акцептора (содержит свободную орбиталь), при этом образуется катион аммония, в котором все четыре связи N - H, независимо от происхождения являются равноценными по характеристикам.
Характеристиками ковалентной связи являются: энергия, длина, насыщаемость, направленность и полярность.
1) Энергия связи 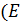 ) – мера её прочности, определяется количеством энергии, необходимой для её разрыва и измеряется в кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина связи уменьшается.
) – мера её прочности, определяется количеством энергии, необходимой для её разрыва и измеряется в кДж/моль. С увеличением кратности связи энергия связи увеличивается, а длина связи уменьшается.
2) Длина химической связи 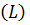 – это межъядерное расстояние, измеряемое в нанометрах (нм). Химическая связь тем прочнее, чем меньше её длина.
– это межъядерное расстояние, измеряемое в нанометрах (нм). Химическая связь тем прочнее, чем меньше её длина.
3) Под насыщаемостью связи понимают способность атомов образовывать определённое количество ковалентных связей в спокойном или в возбужденном состоянии. Состояние возбуждения вызывается получением энергии извне и сопровождается увеличением числа одноэлектронных облаков на внешнем квантовом сле. При этом возбуждение возможно, если на внешнем квантовом слое есть двуэлектронные облака и вакантные орбитали. Энергия, затраченная на превращение двуэлектронных облаков в одноэлектронные в пределах одного квантового слоя, как правило, компенсируется гибридизацией атомных орбиталей и образованием дополнительных связей, так как оба эти процесса являются экзотермическими. Например, максимальная ковалентность атома бора, равная трём, реализуется в возбужденном состоянии:
5B 1s22s22p1 – спокойное (нормальное) состояние
5B 1s22s12p2 - возбуждённое состояние.
4) Направленность связи определяется областью максимального перекрывания электронных облаков атомов, образующих химическую связь и формирует пространственную конфигурацию молекул. Направленность связи обусловливает пространственную структуру молекул, т.е. их геометрию. Рассмотрим это на примере молекулы хлороводорода. Ковалентная связь возникает в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов. При образовании молекулы HCI происходит перекрывание s- орбитали атома H (водорода) и pх- орбитали атома CI (хлора). Образовавшаяся молекула является линейной, угол связи 1800 (рис. 6).
| + |
| + |
| Х |
| Н 1s1 |
| Cl 3px1 |
| +δ |
| -δ |
| Рис.6 Образование полярной σ -связи в молекуле HCl |
заряда электрона (qē):
μ = l∙qē . (16)
3.2 Ионная связь
Ионная связь — крайний случай поляризации ковалентной полярной связи,очень прочная химическая связь, образующаяся между атомами с большой разностью в значениях ОЭО (Δχ>1,5 по шкале Полинга), при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Ионная или электровалентная связь осуществляется электростатическим взаимодействием между противоположно заряженными ионами. В этих случаях образуются гетерополярные или ионные соединения. Например, рассмотрим процесс образования фторида натрия из электронейтральных атомов. Атом натрия, имеющий один электрон на внешнем квантовом слое 11Na: 1s2 2s2 2p6 3s1, превращается в катион, а атом фтора, имеющий семь электронов на внешнем квантовом слое 9F: 1s2 2s2 2p5, превращается в анион:
Na -1ē → Na+ ( 1s22s22p63s0); F + 1ē → F- (1 s22s22p6).
При образовании связи между ними оба элемента приобретают внешнюю электронную оболочку благородного газа неона (10Ne: 1s2 2s2 2p6).
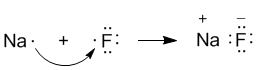
Теперь в дополнение к ковалентной составляющей химической связи в молекуле Na+:F– добавляется еще и электростатическое притяжение между ионами натрия и фтора. Это увеличивает прочность химической связи. Однако ковалентная составляющая (стремление к октету) продолжает играть большую роль и в ионных соединениях.
Взаимное притяжение противоположно заряженных ионов формирует ионную связь. Ионная связь характеризуется ионной кристаллической решеткой, сформированной силами притяжения разноименных ионов и силами отталкивания одноименных ионов. Ионная связь характеризуется: определённым типом кристаллической решетки, энергией связи, межионным расстоянием, ненаправленностью и ненасыщаемостью. Истинно ионная связь может быть образована атомами металлов и неметаллов, разница электроотрицательностей которых превышает две единицы: D 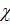 = c(1) - c(2) ,
= c(1) - c(2) ,
где c(1) - электроотрицательность неметалла, а c(2) - электроотрицательность металла. В действительности связи не бывают абсолютно ионными, поэтому говоря о степени или доли ионности, которую можно определить опытным путём. Ионная связь характеризуется ненаправленностью в пространстве и ненасыщаемостью, т.к. взаимодействие ионов противоположных знаков не приводит к компенсации силовых полей. Таким образом, вследствие ненасыщаемости и ненаправленности ионные соединения представляют собой твёрдые кристаллические тела с ионным типом решетки и ионной проводимостью.
3.3. Металлическая связь.
Металлическая связь - это особый вид химической связи, реализующейся в металлах, сплавах, в соединениях металлов друг с другом (интерметаллидах) и, несколько реже, в соединениях металлов с неметаллами низкой электроотрицательности. К металлам относятся ¾ части элементов Периодической Системы. Это кристаллические (за исключением ртути) вещества, в узлах кристаллической решетки которых находятся положительно поляризованные атомы. Основными типами кристаллических решеток металлов являются: объемно-центрированная кубическая, гранецентрированная кубическая и гексагональная.
| Число атомов |
| 1 2 8 12 NA |
| Рис. 7. Сема образования энергетической зоны кристалла |
| Е |
 Современной теорией химической связи в металлах является зонная теория, которая описывает химическую связь в простых кристаллических веществах. При сближении атомов на расстояния, соизмеримые с их собственными размерами, атомные орбитали начинают видоизменяться, так как находящиеся на них электроны должны испытывать влияние не только собственного ядра, но и ядер соседних атомов, а также отталкивание соседних электронных облаков. В итоге, атомные орбитали преобразуются в молекулярные. Количество возникающих молекулярных орбиталей совпадает с числом исходных атомных орбиталей. Часть молекулярных орбиталей имеют энергию, более низкую, чем у исходных атомных, а часть более высокую энергию. Если общие электроны оказываются на более низких по энергии орбиталях, то происходит выигрыш и выделение энергии. Зонная теория учитывает, что в кристаллических веществах, сближенными оказывается много атомов, и возникает множество близких по энергии молекулярных орбиталей, образующих энергетические зоны (рис. 7). Молекулярные орбитали в энергетической зоне заполняются по тем же принципам, что и атомные, т. е. в соответствии с принципом наименьшей энергии, принципом Паули, запрещающем находиться на одной орбитали более чем двум электронам. Если общее количество размещаемых электронов оказывается меньше, чем удвоенное число молекулярных орбиталей, то орбитали, более высокие по энергии, окажутся незанятыми, - образуется вакантная зона. Зона, заполненная электронами, называется валентной, а пустая зона более высоких энергий – зоной проводимости. Незначительные отличия в энергиях уровней валентной зоны и зоны проводимости в области их соприкосновения позволяет электронам под действием любого энергетического импульса (энергия тепловых колебаний, градиент электрического поля и др.) переходить в зону проводимости. Электроны в зоне проводимости становятся делокализованными, легко перемещаются в объеме кристалла. Совокупность таких нелокализованных электронов в зоне проводимости, принадлежащая всему кристаллу в целом, называется электронным газом. Электронный газ осуществляет химическую связь в кристалле металла. Связь при этом является делокализованной и называется металлической.
Современной теорией химической связи в металлах является зонная теория, которая описывает химическую связь в простых кристаллических веществах. При сближении атомов на расстояния, соизмеримые с их собственными размерами, атомные орбитали начинают видоизменяться, так как находящиеся на них электроны должны испытывать влияние не только собственного ядра, но и ядер соседних атомов, а также отталкивание соседних электронных облаков. В итоге, атомные орбитали преобразуются в молекулярные. Количество возникающих молекулярных орбиталей совпадает с числом исходных атомных орбиталей. Часть молекулярных орбиталей имеют энергию, более низкую, чем у исходных атомных, а часть более высокую энергию. Если общие электроны оказываются на более низких по энергии орбиталях, то происходит выигрыш и выделение энергии. Зонная теория учитывает, что в кристаллических веществах, сближенными оказывается много атомов, и возникает множество близких по энергии молекулярных орбиталей, образующих энергетические зоны (рис. 7). Молекулярные орбитали в энергетической зоне заполняются по тем же принципам, что и атомные, т. е. в соответствии с принципом наименьшей энергии, принципом Паули, запрещающем находиться на одной орбитали более чем двум электронам. Если общее количество размещаемых электронов оказывается меньше, чем удвоенное число молекулярных орбиталей, то орбитали, более высокие по энергии, окажутся незанятыми, - образуется вакантная зона. Зона, заполненная электронами, называется валентной, а пустая зона более высоких энергий – зоной проводимости. Незначительные отличия в энергиях уровней валентной зоны и зоны проводимости в области их соприкосновения позволяет электронам под действием любого энергетического импульса (энергия тепловых колебаний, градиент электрического поля и др.) переходить в зону проводимости. Электроны в зоне проводимости становятся делокализованными, легко перемещаются в объеме кристалла. Совокупность таких нелокализованных электронов в зоне проводимости, принадлежащая всему кристаллу в целом, называется электронным газом. Электронный газ осуществляет химическую связь в кристалле металла. Связь при этом является делокализованной и называется металлической.
Металлическая связь является ненасыщенной и ненаправленной. Т.к. при увеличении числа взаимодействующих атомов главный признак металлической связи (делокализация электроннов) не исчезает, а усиливается. Ненаправленность обусловлена шаровой симметрией облаков s- электронов. Вследствие этого веществам с металлической связью присущ ряд общих свойств:
а) высокая электропроводность;
б) теплопроводность;
в) так как связь между атомами поддерживает электронный газ, смещение атомных слоев относительно друг друга под действием внешних сил не приводит к полному нарушению химической связи и разрушению кристалла, а происходит только перераспределение электронной плотности в объеме кристалла – это объясняет пластичность металлов;
г) множество МО в энергетической зоне, слабо отличающихся по энергии, позволяет металлам отражать свет с любой длиной волны, поэтому металлы кажутся светло-серыми и блестящими.
Зонная теория объясняет зависимость энергии металлической связи металлов от их электронного семейства. Энергия связи определяет различия в прочности и большие отличия температур плавления и кипения металлов. Наибольшими температурами плавления (наибольшей энергией связи) отличаются d-металлы центральной части таблицы ПС, так как в атомах этих металлов наибольшее количество d-орбиталей принимают участие в образовании энергетических уровней в энергетической зоне кристалла металла. Прочность связи у металлов s-семейства невелика, это мягкие металлы с невысокими температурами плавления. У металлов s-семейства в образовании связи участвует малое число электронов. У металлов II(А)-подгруппы механическая прочность больше, чем в I(А); р-металлы имеют прочность, большую, чем s- металлы, но заметно меньшую, чем d- элементы.
3.4. Водородная связь
Водородная связь — это своеобразная химическая связь. Она может быть межмолекулярной и внутримолекулярной. Межмолекулярная водородная связь возникает между молекулами, в состав которых входят водород ковалентно связанный с сильно электроотрицательным элементом (фтор, кислород, азот, реже хлор, сера). Поскольку в такой молекуле общая электронная пара сильно смещена от водорода к атому электроотрицательного элемента, а положительный заряд водорода сконцентрирован в малом объеме, то протон частично входит в электронное облако неподеленной электронной пары атома электроотрицательного элемента другой молекулы. В результате образуется связь более слабая, чем ковалентная, получившая название водородной.
В качестве примера рассмотрим образование водородной связи между молекулами воды. Молекула воды имеет следующее строение (рис.8).
| Рис.8. Модель молекулы воды |
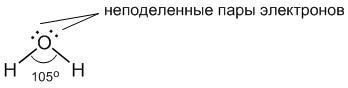 Две поделенные электронные пары атома кислорода участвуют в образовании двух полярных ковалентных связей с двумя атомами водорода, а оставшиеся две неподеленные пары электронов играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга.
Две поделенные электронные пары атома кислорода участвуют в образовании двух полярных ковалентных связей с двумя атомами водорода, а оставшиеся две неподеленные пары электронов играют важную роль в свойствах воды. Все заместители у атома кислорода, включая неподеленные пары, стремятся расположиться как можно дальше друг от друга.
Это приводит к тому, что молекула воды приобретает форму искаженного тетраэдра с атомом кислорода в центре. В четырех вершинах этого "тетраэдра" находятся два атома водорода и две неподеленные пары электронов. Молекула воды имеет угловое строение (угол Н–О–Н составляет около 105 градусов) и является ярко выраженным диполем с большим значением дипольного момента (μ = 6,13∙10-30 Кл∙м). Ядра атомов водорода, входящие в состав молекулы воды, из-за смещения общей элетронной плотности на атом кислорода почти лишаются электронного облака с ″внешней″ стороны по отношению к этому атому.
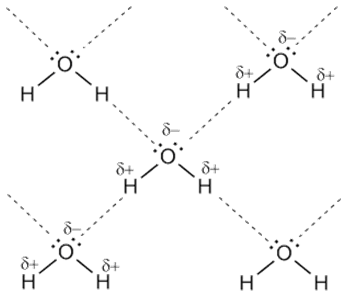
Рис. 9 Схема образования ассоциата воды 
|
Особенно заметную роль играют водородные связи в молекулах белковых тел и нуклеиновых кислотах.
По механизму образования водородная связь может быть охарактеризована как следствие электростатического взаимодействия и донорно-акцепторного механизма.
Примеры решения типовых задач
Пример 1. Для гидросульфата натрия постройте графическую формулу и укажите виды химической связи в молекуле: ионная, ковалентная, полярная, ковалентная неполярная, координационная, металлическая, водородная.
Решение
NaHSO4— 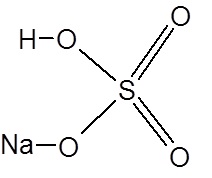
Связь O – Na – ионная; связь O – S – ковалентная полярная;
связь O – H– ковалентная полярная
Пример 2. Определите, как меняется прочность соединений в ряду галогеноводородов с ростом заряда ядра галогена.
Решение
Прочность связи двухатомных молекул зависит от энергии связи и длины связи. Для соединений, образованных полными электронными аналогами, прочность связи определяется длиной связи. С ростом атомного радиуса в ряду: F→Cl→Br→I длина связи увеличивается, т. е. уменьшается область перекрывания электронных облаков связи и, соответственно, прочность cвязи ряду HF, HCI, HBr, HI уменьшается (сила кислоты увеличивается).
Пример 3. В каком из соединений NaI, NaBr, CsI связь является наиболее полярной?
Решение
Находим разности относительных электроотрицательностей (χ) элементов, образующих связи: а) Na─I Dc = χ (I) – χ (Na) = 2, 21 – 1, 01 = 1, 20;
б) Na─Br Dc = χ (Br) - χ (Na) = 2,74 – 1,01 = 1,73;
в) Cs─I Dc = χ (I) - χ (Cs) = 2, 21 - 0, 86 = 1, 35.
Наиболее полярная связь в молекуле Na ─ Br, т.к. Dc в данном случае максимальна.
Пример 4. Охарактеризуйте геометрию молекулы метана (СН4).
| Е |
| 1s |
| 2s |
| 2p |
| Рис.11. Схема 2. |
| Е |
| 1s |
| 2s |
| 2p |
| Рис.10. Схема 1. |
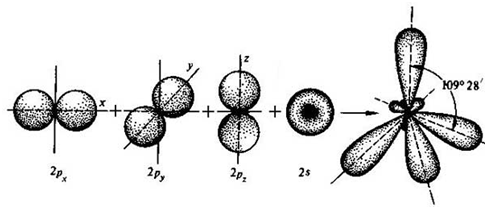
| Рис.12 Схема 3 |
Пример 5. Какие силы межмолекулярного взаимодействия называются диполь-дипольными (ориентационными), индукционными и дисперсионными? Объясните природу этих сил. Какова природа преобладающих сил межмолекулярного взаимодействия в каждом из следующих веществ: H2O, H I , Ar, N2, NH3?
Решение
Межмолекулярное взаимодействие имеет электрическую природу и складывается из сил притяжения (ориентационных, индукционных и дисперсионных) и сил отталкивания.
1) Ориентационные силы действуют между полярными молекулами, то есть обладающими дипольными электрическими моментами (μ1, μ2). Сила притяжения между двумя полярными молекулами максимальна в том случае, когда их дипольные моменты располагаются вдоль одной линии (схема 4).
| + + + |
| a |
| b |
| c |
| d |
| + |
| ─ |
| ─ |
| Рис.13 Схема 4 |
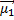
|
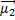
|
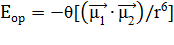 , (17)
, (17)
где: μ1 и μ2 — дипольные моменты взаимодействующих молекул; ϴ - коэффициент пропорциональности, зависящий от температуры; r – расстояние между центрами диполей.
2) Индукционные (или поляризационные) взаимодействия возникают между полярной и неполярной молекулами. Полярная молекула создаёт электрическое поле, которое поляризует молекулу с электрическими зарядами, равномерно распределёнными по объёму. В результате в неполярной молекуле индуцируется (наводится) временный дипольный момент, который определяется поляризуемостью (α) второй молекулы. Энергия межмолекулярного взаимодействия (Еинд, кДж/моль) в этом случае пропорциональна дипольному моменту (μ1) полярной молекулы и величине поляризуемости (α2) неполярной молекулы:
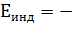 Q
Q 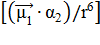 , (18)
, (18)
где: Q - коэффициент пропорциональности. Эта энергия называется индукционной.
3) Между неполярными молекулами возникает дисперсионное молекулярное взаимодействие, потенциальная энергия (Едисп, кДж/моль) которого определяется:
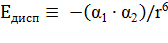 , (19)
, (19)
где: α1, α2 – поляризуемость взаимодействующих молекул. Причиной такого типа межмолекулярного взаимодействия являются различные формы движения частиц внутри молекулы (колебательные движения ядер атомов, движение электронов в поле ядра, поступательное, вращательное, колебательное движение атомов и атомных группировок в молекуле), что вызывает возникновение мгновенных диполей. Мгновенный диполь создаёт электрическое поле, поляризующее соседние молекулы и как следствие возникает взаимодействие мгновенных диполей. Энергия межмолекулярного взаимодействия всегда отрицательна, т.к. результатом взаимодействия диполей может быть только сближение (сцепление) молекул (силы притяжения в квантовой механике обозначаются со знаком минус). При сравнении относительной величины различных межмолекулярных взаимодействий можно сделать вывод: а) ориентационный эффект исчезающе мал для молекул, имеющих малые дипольные моменты (СО, HI и др.), только для молекул с очень большим дипольным моментом (NH3, H2O) он превышает дисперсионный эффект (в 3 раза для молекул воды); б) индукционный эффект всегда мал, его величина составляет не более 5 % суммарного эффекта межмолекулярных сил; в) дисперсионные силы действуют между всеми атомами и молекулами, так как механизм их появления не зависит от того, есть ли у молекул (атомов) постоянные дипольные моменты или нет, обычно эти силы превосходят по величине как ориентационные, так и индукционные, при взаимодействии же таких полярных молекул, как CO, HI, HBr и других, дисперсионные силы в десятки и сотни раз превосходят все остальные.
Все три типа межмолекулярных взаимодействий одинаковым образом убывают с расстоянием:
ΣЕ = Еop + Еинд + Едисп ≡ r-6 . (20)
Из данных веществ ориентационное и индукционное взаимодействие имеет место в веществах с полярными молекулами: Н2О и NH 3. Дисперсионное взаимодействие в веществах с неполярными и малополярными молекулами: HI , Ar , N 2 .
Контрольные вопросы и задания
Вариант 1.
1. Определите, как меняется прочность связи соединений в ряду: H2S, H2Se, H2Te.
2. Укажите максимальую ковалентность атома хлора.
3. Какие из предложенных соединений имеют ионный тип связи: HI, HCI, NaCI, KF, NH3, CaCI2, CsF, LiCI? Ответ мотивируйте.
4. Какие соединения могут образовывать водородные связи: HI, HCI, H2O, CsF, NaF, HF. Ответ мотивируйте.
5. Охарактеризуйте геометрию молекулы воды (H2O).
Вариант 2.
1. Охарактеризуйте геометрию молекулы BH3
2.Какая из связей наиболее полярна: P - H, N - H, S - H, CI - H?
3. Почему максимальная валентность кислорода равна двум, а серы – шести?
4. Какая из связей более прочная: HF, HBr, HI?
5. Какие из предложенных атомов могут между собой образовывать ионные соединения: Na, S, CI, K, Br?
Вариант 3
1.Определите валентность атома серы в соединениях: SO2, SO3, H2S, H2SO3.
2. Охарактеризуйте геометрию молекулы BCI3.
3. Какая из связей наиболее полярна P - H, N - H, S - H?
4. Приведите формулы соединений и укажите тип связи в них, если в их образовании принимали участие атомы CI, H, Ca, Cs, F.
5. Почему максимальная валентность фтора равна единице, а хлора – семи?
Вариант 4
1. Может ли молекула простого вещества быть полярной? Ответ обосновать.
2. Приведите основное различие между ковалентной и ионной связями.
3. Почему существуют соединения, где атом серы шестивалентен? Возможно ли такое состояние для кислорода?
4. Какая связь характеризуется максимальной ионностью: , CsF, NaF, HF?
5. Какова геометрия молекул H2O и H2S , в чем их сходство и различие?
Вариант 5
1. Как меняется прочность связи в ряду: N - CI, P - CI, As - CI ?
2. Какие валентности могут проявлять электронные аналоги: азот и фосфор? Какой тип связи характерен для простых веществ этих элементов?
3. Образует ли атом кальция соединение с водородом, и какой тип связи должен иметь этот гидрид?
4. Могут ли атомы металлов принимать участие в образовании ковалентной связи?
5. Какова геометрия молекулы PCI3? Ответ обосновать.
Вариант 6
1. Какая из связей характеризуется наибольшей степенью ионности, если электроотрицательность элементов Cl (3,0); K (0,91); Ge (2,0); P (2,2): а) К – Cl; б) Ge – Cl; в) Р – Cl.
2. Связь, осуществляемая благодаря образованию общих электронных пар, называется: а) ковалентной; б) ионной; в) водородной.
3. Ковалентная полярная связь возникает между атомами элементов: а) Cl и H; б) K и Cl; в) N и H. Приведите объяснение.
4. Какие из свободных атомов совершенно лишены способности к химическому взаимодействию: а) Ne; б) Na; в) H2? Почему?
5. Какое из двух соединений ковалентное неполярное, а какое - полярное ковалентное: F-F, Cl-F ? Ответ мотивируйте.
Вариант 7
1. Из данного перечня выберите вещества с ионным характером связи:
H2O, K2O, HF, F2O, KF, NaOH, H2SO4, Na2SO4. Между какими частицами существует данный тип связи?
2. Привести валентные формулы и определить тип химической связи в следующих веществах: а) Li2O, б) HBr, в) KBr, г) Br2O, д) Br2, указать направление смещения общих электронных пар при образовании связи.
3. Температуры (Т, К) кипения благородных газов имеют значения:
| Газ | He | Ne | Ar | Kr | Xe | Rn |
| Т, К | 4,3 | 27,2 | 87,3 | 119,9 | 165,0 | 211,2 |
Чем объясняется повышение температуры кипения с возрастанием порядкового номера благородного газа?
4. Каким типом гибридизации атомных орбиталей азота описывается образование иона NH4+ и молекулы NH3? Какова пространственная структура этих частиц?
5. Как меняется прочность связи в ряду: N - CI, P - CI, As - CI ?
Вариант 8
1. Дипольные моменты молекул H2O, H2S равны соответственно 1,84 и 0,94D. Вычислите длины диполей. В какой молекуле связь более полярна? Укажите направление дипольных моментов связей в этих молекулах.
2. При взаимодействии плавиковой кислоты с тетрафторидом кремния образуется частица [SiF6]2-. Объясните механизмы образования химической связи между атомом кремния и атомами фтора в данной частице.
3. Какие валентности могут проявлять электронные аналоги: сера и селен? Какой тип связи характерен для простых веществ этих элементов?
4. Почему максимальная валентность фтора равна единице, а хлора – семи?
5. В каком из приведенных соединений: LiF, BeF2, BF3, CF4 связь Э─F будет больше всего приближаться к малополярной ковалентной? Объясните.
Вариант 9
1. Связь, осуществляемая благодаря образованию общих электронных пар, называется: а) ковалентной; б) ионной; в) водородной.
2. Какие валентности могут проявлять электронные аналоги: ванадий и ниобий? Почему именно такие валентности?
Для гидрокарбоната натрия постройте графическую формулу и укажите виды химической связи в молекуле: ионная, ковалентная, полярная, ковалентная неполярная, координационная, металлическая, водородная. Какая из связей наиболее приближается к ионной?
4. Чем можно объяснить аномально высокую температуру кипения воды (tкип, oС) в ряду водородных соединений халькогенов?
| вещество | H2Te | H2Se | H2S | H2O |
| tкип, oС | −2 | −42 | −60 | 100 |
5. Почему существуют соединения, где атом серы шестивалентен? Возможно ли такое состояние для кислорода?
Вариант 10
1. Энергия ионизации атомов фтора и хлора составляет соответственно 17,4 и 13,0 эВ, энергия сродства к электрону соответственно 3,45 и 3,61 эВ. Для какого из этих элементов более характерно образование ионных соединений? Объясните.
2. Какая связь называется координационной? Какие частицы могут участвовать в образовании координационной связи: а) BF3 и F–; б) NH3 и H2O; в) NH3 и Zn?
3. Образует ли атом кальция соединение с водородом, и какой тип связи должен иметь этот гидрид?
4. Каким типом гибридизации атомных орбиталей азота описывается образование иона NH4+ и молекулы NH3? Какова пространственная структура этих частиц?
5. Связь, осуществляемая благодаря образованию общих электронных пар, называется: а) ковалентной; б) металлической; в) водородной.
Вариант 11
1. Какая химическая связь называется водородной? Между молекулами каких веществ она образуется? Почему H2O и HF, имея меньшую молекулярную массу, плавятся и кипят при более высоких температурах, чем аналогичные соединения H2S и НСl?
2. Приведите валентные формулы соединений с ковалентной связью: хлор, метан, сероводород, вода.
3. Почему существуют соединения, где атом серы шестивалентен? Возможно ли такое состояние для кислорода?
4. Какой способ образования ковалентной связи называется донорно-акцепторным? Какие химические связи имеются в ионах BF4- и NH4+ ? Укажите донор и акцептор.
5. Какие валентности могут проявлять электронные аналоги: титан и цирконий, какой тип связи характерен для простых веществ этих элементов?
Вариант 12
1. Каков физический смысл металлической связи? Какие физико-механические характеристики простого вещества определяются данным типом связи?
2. Какие валентности могут проявлять электронные аналоги: цинк и кадмий? Какой тип связи характерен для простых веществ этих элементов?
3. Ковалентная полярная связь возникает между атомами элементов: а) S и H; б) Li и Cl; в) N и N . Приведите объяснение.
4. Какие из свободных атомов совершенно лишены способности к химическому взаимодействию: а) Ne; б) Na; в) H2? Почему?
5. Какие из предложенных атомов могут между собой образовывать ионные соединения: Na, S, CI, K, Br? Почему?
Раздел 4
Закономерности протекания химических процессов
4.1. Энергетика химических процессов
Любой процесс, каким бы он ни был по своей сути, всегда совершается с определенным энергетическим эффектом. Наука, изучающая взаимные превращения энергии, теплоты и работы называется термодинамикой. Химическая термодинамика – это наука, изучающая энергетику химических и фазовых превращений, а также направление и глубину протекания процессов в физико-химических системах.
Система – это совокупность материальных объектов, находящихся во взаимосвязи и взаимозависимости и отделенная от окружающей среды поверхностью раздела. Совокупность одинаковых по составу, структуре и свойствам участков системы называется фазой. Фаза – часть системы, однородная посоставу и свойствам и отделенная от других частей системы поверхностью раздела фаз.
Общими физическими параметрами системы являются:
1) общий энергетический запас (Е, Дж), 2) масса (m, кг),
3) давление (Р, Па), 4) температура (Т, К), 5) объем (V, м3).
Классификация термодинамических систем: а) гомогенные и гетерогенные системы (по отсутствию или наличию межфазной границы); б) изолированные, закрытые, открытые системы (по возможности обмена системы с окружающей средой тепловой энергией, веществом и информацией); в) однородные и неоднородные системы (по количеству компонентов в системе).
Состояние системы характеризуется ее физическими и химическими свойствами. Свойства, выбранные в качестве независимых переменных, называются параметрами состояния. Величина, определяемая этими параметрами, однозначно характеризующая систему и независящая от пути ее перехода из одного состояния в другое, называется функцией состояния.
Термодинамическими функциями состояния являются:
1) внутренняя энергия (U) характеризует общий запас энергии в системе, исключая кинетическую энергию системы как целого и ее потенциальную энергию в поле внешних сил, если ΔU = Uкон – Uисх > 0 то внутренняя энергия системы возрастает;
2) энтальпия (Н) характеризует общее энергосодержание системы или изменение энтальпии (Δ Н) - тепловой эффект химической реакции при постоянном давлении (P-const, изобарный процесс),
ΔН > 0 тепло поглощается, эндотермическая реакция;
ΔН < 0 тепло выделяется, экзотермическая реакция;
3) энтропия ( S ) характеризует меру термодинамической вероятности системы, беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики),
ΔS > 0 степень беспорядка возрастает;
ΔS < 0 cтепень беспорядка уменьшается;
4) свободная энергия Гиббса ( G ) или изобарно-изотермический потенциал характеризует часть энергии системы, идущую на совершение полезной работы:
ΔG = ─А, при постоянных давлении и температуре (P, Т - const),
ΔG > 0 энергия поглощается, самопроизвольное протекание реакция в данных условиях невозможно;
ΔG < 0 энергия выделяется, реакция в данных условиях протекает самопроизвольно;
5) свободная энергия Гельмгольца (F) или изохорно-изотермический потенциал характеризует часть энергии, идущую на совершение полезной работы при V, Т – const,
Δ F > 0 энергия поглощается, Δ F < 0 энергия выделяется.
В общем случае при переходе системы из одного состояния в другое внутренняя энергия изменяется одновременно как за счет совершения работы, так и за счет передачи теплоты.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы и является справедливым для систем с любым числом структурных единиц. Он формулируется следующим образом:
Количество теплоты ( Q), сообщаемое термодинамической системе, равно сумме изменения ее внутренней энергии (Δ U ) и работы (А), совершаемой системой против внешних сил:
Q = Δ U + А. (21)
Если работа совершается внешними силами над термодинамической системой, то первый закон термодинамики можно записать в виде уравнения:
Q + А = Δ U (22)
То количество теплоты (Q), которое выделяется либо поглощается в ходе реакции, называется тепловым эффектом процесса. В термохимическом правиле знаков для теплоты положительной считают теплоту, отдаваемую системой Q >0, экзотермический процесс, а отрицательной — теплоту, получаемую системой Q<0, эндотермический процесс, т. е. знаки перед {\displaystyle U} Q и {\displaystyle Q} ΔU в математическом выражении для первого закона термодинамики противоположны.
Применение первого закона термодинамики для определения тепловых эффектов процессов протекающих в различных условиях.
1. Изохорные процессы.
Т.к. объем системы постоянный (V = const, Δ V=0), следует работа системы против внешних сил отсутствует (А= Р∙ Δ V=0). Тепловой эффект будет определятся только изменением внутренней энергии QV = ΔU, или в термохимической системе знаков: QV = ─ΔU.
2. Изобарные процессы.
Процесс протекает при постоянном давлении (P - const), при этом система совершает работу по изменению своего объема (А= Р∙ Δ V). Сумма внутренней энергии системы и работы определяет ту часть энергии системы, которая доступна для преобразования в теплоту при определенном постоянном давлении, т.е. энтальпию (Н) или энергию расширенной системы, Н = U+ Р∙V. Изменение энтальпии в изобарном процессе будет определятся ΔН = ΔU+ Р∙ΔV или ΔН = ΔU + А. Следует, тепловой эффект изобарного процесса равен изменению энтальпии процесса, взятого с обратным знаком: QР = ─ΔН.
Тип процесса: 1) изохорный, V = const; 2) изобарный, P = const.
| Термодинамическая функция, определяющая тепловой эффект процесса и название процесса | |||
| ΔU>0, QV <0 эндотермический процесс | ΔН>0, QР <0 эндотермический процесс | ||
| ΔU<0, QV >0 экзотермический процесс | ΔН<0, QР >0 экзотермический процесс | ||
Термохимические уравнения реакций - это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов (ΔНХ.Р.), а стехиометрические коэффициенты могут иметь нецелочисленные значения. Пример термохимического уравнения гомогенного процесса в общем виде:
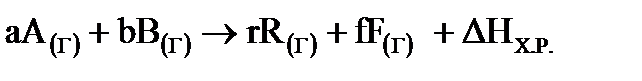 ,
,
где a,b,r,f – стехиометрические коэффициенты газообразных веществ А, В, R, F, участвующих в процессе, соответственно. {\displaystyle H=E=U+pV}
{\displaystyle \Delta H=H_{2}-H_{1}}
Дата: 2018-11-18, просмотров: 1030.