| Рис. 1. Схема деления
энергетической зоны оболочки атома на уровни и подуровни
|
Согласно принципу квантованности энергии, вся энергетическая зона вокруг ядра в атоме распадается на энергетические уровни с точно определенным запасом энергии.
Энергетический уровень — собственные значения энергии электронов и других элементарных частиц. Всегда в атоме имеются электроны с близкими значениями энергии, которые образуют электронные слои в оболочке атома. Т.е.
энергетический уровень – это электронный слой с определённым уровнем энергии находящихся на нём электронов. Каждый уровень характеризуется определённым состоянием системы, или подмножеством таковых в случае вырождения, т. е распад на подуровни (Рис.1). Число энергетических уровней в электронной оболочке атома химического элемента равно номеру периода, в котором этот элемент расположен.
Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится
. Это целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему. Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему (например, электрон). Набор квантовых чисел, исчерпывающе описывающих микросистему, называют полным и определяется четырьмя квантовыми числами:
I . Главное квaнтовое число
n определяет общий запас энергии электрона. Физический смысл главного квантового числа - определяет степень удалённости (эффективный радиус) орбитали электрона от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (
n = 1, 2, 3, . . .∞) Эффективные радиусы электронных облаков с одинаковыми значениями главного квантового числа примерно равны, а с разными значениями
n – сильно отличаются. Из-за этого электронная оболочка атома оказывается слоистой. (Точные квантово-механические расчеты показывают, что радиусы облаков одного слоя немного различаются, но эти различия незначительны).
II. Орбитальное (побочное или азимутальное) квантовое число l характеризует момент количества движений электрона (его импульс) на данном энергетическом уровне. Физический смысл орбитального числа - определяет геометрическую форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению орбитального числа соответствует орбиталь особой геометрической формы, т. е. энергетический подуровень (табл. 7 ).
Квантовые числа
Таблица 7
| значение числа l
| геометрическая форма орбитали
| обозначение и название орбитали(подуровня)
| степень вырождения орбитали
|
| 0
| шар
| s
| 1
|
| 1
| объемная восьмёрка
| p
| 3
|
| 2
| 4-х лепестковая
| d
| 5
|
| 3
| 8-ми лепестковая
| f
| 7
|
| Рис.2. Орбитали s, p - подуровней
|
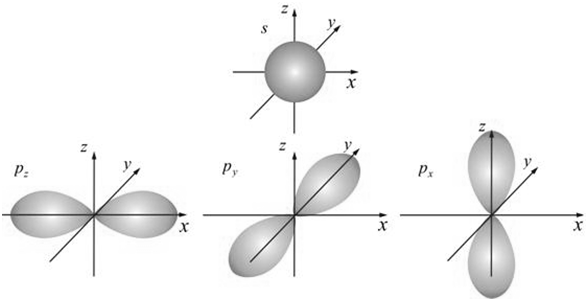 III .
III . Магнитное квантовое число
m характеризует ориентацию и направление орбитали в пространстве под действием внешних магнитных полей. Число
m может иметь значения:
m = -
l …0…+ l . Количество значений числа
m для данной формы орбитали определяет количество вариантов ориентации данной геометрической формы орбитали, т.е. степень вырождения орбитали. Например: для шаровой формы орбитали (
s – орбитали) при
l = 0 значение числа
m может быть только одно m = 0, т.е. количество вариантов ориентации равно 1. Для электронов р – подуровня (с геометрической формой орбитали – объемной восьмеркой) и значением числа
l = 1, число m может иметь значения: -1, 0, +1, т.е. три варианта ориентации: по осям x, y, z (рис. 2). Таким образом, р-подуровень вырожден 3-х кратно: p
x, p
y, p
z.
Аналогично, d – подуровень (l =2) вырожден 5-ти кратно, т.к. число m может иметь значения: -2, -1, 0, +1, +2, а f – подуровень (l =3) вырожден 7 – ми кратно (m: -3, -2, -1, 0, +1, +2, +3).
IV . Спиновое квантовое число S может принимать лишь два возможных значения: +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона. Обозначение электрона со спиновым числом S = +1/2 (↑) и S = -1/2(↓).
 III . Магнитное квантовое число m характеризует ориентацию и направление орбитали в пространстве под действием внешних магнитных полей. Число m может иметь значения: m = -l …0…+ l . Количество значений числа m для данной формы орбитали определяет количество вариантов ориентации данной геометрической формы орбитали, т.е. степень вырождения орбитали. Например: для шаровой формы орбитали (s – орбитали) при l = 0 значение числа m может быть только одно m = 0, т.е. количество вариантов ориентации равно 1. Для электронов р – подуровня (с геометрической формой орбитали – объемной восьмеркой) и значением числа l = 1, число m может иметь значения: -1, 0, +1, т.е. три варианта ориентации: по осям x, y, z (рис. 2). Таким образом, р-подуровень вырожден 3-х кратно: px, py, pz.
III . Магнитное квантовое число m характеризует ориентацию и направление орбитали в пространстве под действием внешних магнитных полей. Число m может иметь значения: m = -l …0…+ l . Количество значений числа m для данной формы орбитали определяет количество вариантов ориентации данной геометрической формы орбитали, т.е. степень вырождения орбитали. Например: для шаровой формы орбитали (s – орбитали) при l = 0 значение числа m может быть только одно m = 0, т.е. количество вариантов ориентации равно 1. Для электронов р – подуровня (с геометрической формой орбитали – объемной восьмеркой) и значением числа l = 1, число m может иметь значения: -1, 0, +1, т.е. три варианта ориентации: по осям x, y, z (рис. 2). Таким образом, р-подуровень вырожден 3-х кратно: px, py, pz.