Распределение электронов по орбиталям в многоэлектронных атомах подчиняется правилам и принципам квантовой механики.
1. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, S ) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположно направленными спиновыми числами (+,-1/2)). Если для данной орбитали известны значения чисел n, l, m (т.е. размер, форма и вариант ориентации орбитали в пространстве), то она называется квантовой орбиталью или квантовой ячейкой.
2. Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма главного и орбитального квантовых чисел (n + l), тем меньше энергия орбитали, она и заполняется в первую очередь. Если для двух подуровней сумма чисел (n + l) одинакова наименьшую энергию имеет орбиталь с меньшим n, она и заполняется в первую очередь.
Энергия орбиталей возрастает в ряду:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d > 4f < 6p < 7s.
3. Правило Хунда. В основном состоянии атома электроны данного подуровня должны распределяться так по квантовым ячейкам, чтобы их суммарный спин был максимален.
Количество квантовых ячеек на данном подуровне определяется вырожденностью данного подуровня, т.е максимально возможным количеством вариантов ориентации орбитали данной формы во внешнем магнитном поле. На s - подуровне одна квантовая орбиталь, на p - подуровне три, на d - подуровне пять, на f - подуровне семь. Так как в одной квантовой ячейке может находится максимум два электрона с антипараллельными спиновыми числами, то максимальное количество электронов на соответствующем подуровне будет равно:
s 2 , p 6, d 10 , f 14 , где количество электронов указывается как число (верхний индекс) справа обозначения подуровня.
Запись, отражающая распределение электронов в атоме химического элемента по энергетическим уровням и подуровням, называется электронной конфигурацией атома. В основном (невозбужденном) состоянии атома все электроны удовлетворяют принципу минимальной энергии. Это значит, что сначала заполняются подуровни, для которых:
1) Главное квантовое число n минимально;
2) Внутри уровня сначала заполняется s- подуровень, затем p- и лишь затем d-подуровень;
3) Заполнение происходит так, чтобы (n + l) было минимально (правило Клечковского);
4) В пределах одного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален, т.е. содержал наибольшее число неспаренных электронов (правило Хунда).
5) При заполнении атомных орбиталей выполняется принцип Паули. Его следствием является то, что энергетическому уровню с номером n может принадлежать не более чем 2n2 электронов.
Электронная формула описывает распределение электронов по энергетическим уровням и подуровням, существующим в электронном облаке. Такое распределение называется также электронной конфигурацией атома. Например, электронная формула кремния 14Si с числом протонов в ядре равном 14 (порядковый номер элемента в таблице Д. И. Менделеева) имеет вид: 1s2 2s2 2p6 3s2 3p2 ,
| Е |
| 1s |
| 2s |
| 2p |
| 3s |
| 3p |
| 3d |
| Рис. 3. Электронно –графическая схема атома кремния 14Si. |
Все квантовые ячейки четырех подуровней заполняются максимально, а последний содержит всего два электрона : 1s2 2s2 2p6 3s2 3p2, приведенная формула соответствует нормальному или стационарному состоянию атома. В данном случае все электроны атома находятся в состояниях с минимальным запасом энергии. Если сообщить электрону в атоме дополнительную энергию, то электрон внешнего электронного слоя может перейти на другую АО с большим запасом энергии, то есть атом окажется в возбужденном состоянии. Для атома кремния это процесс преобразования геометрической формы одного из 3s электронов и переход этого электрона в состояние с большей энергией (3p). Электронная формула атома кремния 14Si* имеет вид: 1s2 2s2 2p6 3s1 3p3. Это состояние неустойчиво, и электрон почти сразу же вернется в исходное состояние, а избыточная энергия выделится. Но если сообщенная электрону энергия достаточно велика, электрон может совсем вылететь из поля действия ядра атома, атом при этом ионизируется , то есть, превращается в положительно заряженный ион (катион):  Энергия, необходимая для этого, называется энергией ионизации атома (E I). Важнейшей энергетической характеристикой атома является энергия сродства (или сродство к электрону) (E F). Это энергия, которая выделяется при присоединении электрона к нейтральному атому, в кДж/моль; допускается внесистемная единица эВ/моль. Сродство к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона, соответственно, оно также периодически изменяется в зависимости от электронной конфигурации атома.
Энергия, необходимая для этого, называется энергией ионизации атома (E I). Важнейшей энергетической характеристикой атома является энергия сродства (или сродство к электрону) (E F). Это энергия, которая выделяется при присоединении электрона к нейтральному атому, в кДж/моль; допускается внесистемная единица эВ/моль. Сродство к электрону численно равно, но противоположно по знаку энергии ионизации отрицательно заряженного иона, соответственно, оно также периодически изменяется в зависимости от электронной конфигурации атома.
Полусумма энергии ионизации и сродства к электрону характеризует способность атома смешать на себя общую электронную плотность химической связи и называется электроотрицательностью (χ ):
χ = 0,5(EI + EF) (13)
Наряду с электронной формулой распределение электронов по квантовым орбиталям дает электронно-графическая схема, которая является энергетической диаграммой, и в которой указываются все заполненные и вакантные орбитали атома (рис.3).
Для характеристики свойств атомов чаще пользуются не полными электронными формулами, а краткими, описывающими только валентную структуру. Валентные – это электроны, которые принимают участие в образовании атомом химических связей. В зависимости от особенностей электронной конфигурации атома, это могут быть электроны только внешнего электронного слоя (s-, p-элементов), а также кроме внешних электронов в образовании химических связей могут участвовать и электроны предвнешнего энергетического уровня (электроны d- подуровня), это d- и f- элементы. Валентная формула кремния: 3s2 3p2.
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре вида – электронные семейства:
1) s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными являются s - электроны внешнего уровня, общая электронная формула n s 1-2.
2) p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I периода и VII). Валентными электронами являются s- и p- электроны внешнего уровня. Общая электронная формула n s2, n p1-6.
3) d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне находятся один или два s- электрона (y 46Pd – ноль). К ним относятся элементы побочных подгрупп (В) больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи). Общая электронная формула (n -1) d1-10, n s2.
4) f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два s –электрона. Они расположены в VI периоде (лантаноиды) и в VII периоде (актиноиды). Общая электронная формула (n -2) f1-14 (n -1) d0-2, n s2.
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов. Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами.
Силы (F), удерживающие электроны в поле действия ядра, это электростатические силы, подчиняющиеся закону Кулона:
 . (14)
. (14)
В квантовой механике закон Кулона формулируется не при помощи понятия силы, как в классической механике, а при помощи понятия потенциальной энергии (Еп) кулоновского взаимодействия электронов и ядер атомов:
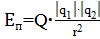 . (15)
. (15)
Потенциальная энергия кулоновского взаимодействия (Еп) ядра атома с зарядом 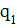 и электронов внешнего слоя с суммарным зарядом
и электронов внешнего слоя с суммарным зарядом 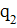 прямо пропорциональна произведению модулей зарядов и обратно пропорциональна квадрату расстояния между ними (эффективному радиусу атома - r). Q – коэффициент пропорциональности. Отсюда, чем меньше электронов на внешнем электронном слое, чем меньше ǀq2ǀ, тем менее устойчив слой, тем более вероятно проявление восстановительных (металлических) свойств, тем меньше энергия ионизации (E I ). Чем больше эффективный радиус атома (r), т.е. чем в более высоком периоде находится элемент, тем менее устойчив внешний электронный слой, тем меньше энергия ионизации (E I ) и ярче выражена металличность элемента. В основе деления всех элементов на металлические и неметаллические лежит устойчивость (завершенность) внешнего электронного уровня. Максимальной устойчивостью обладает внешний электронный слой, имеющий полностью заполненные электронами квантовые орбитали s- и р- подуровней (т.е. восемь электронов).
прямо пропорциональна произведению модулей зарядов и обратно пропорциональна квадрату расстояния между ними (эффективному радиусу атома - r). Q – коэффициент пропорциональности. Отсюда, чем меньше электронов на внешнем электронном слое, чем меньше ǀq2ǀ, тем менее устойчив слой, тем более вероятно проявление восстановительных (металлических) свойств, тем меньше энергия ионизации (E I ). Чем больше эффективный радиус атома (r), т.е. чем в более высоком периоде находится элемент, тем менее устойчив внешний электронный слой, тем меньше энергия ионизации (E I ) и ярче выражена металличность элемента. В основе деления всех элементов на металлические и неметаллические лежит устойчивость (завершенность) внешнего электронного уровня. Максимальной устойчивостью обладает внешний электронный слой, имеющий полностью заполненные электронами квантовые орбитали s- и р- подуровней (т.е. восемь электронов).
Правило октета утверждает, что все элементы стремятся приобрести или потерять электрон, чтобы иметь восьмиэлектронную конфигурацию ближайшего благородного газа. Т.к. внешние s- и p-орбитали благородных газов полностью заполнены, то они являются самыми стабильными элементами.
2.2. Периодический закон и периодическая система элементов
Д .И. Менделеева
Основной закон химии Периодический закон был открыт Д. И. Менделеевым в 1869 году. Современная формулировка закона:
Свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов и их электронной структуры.
Наиболее важные свойства химических элементов, имеющие особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений и находящиеся в периодической зависимости от порядковых номеров (т.е. зарядов ядер атомов) являются следующие:
1). энергией ионизации атома (E I ); 2). энергия сродства к электрону (E F );
3). электроотрицательность (χ); 4). правило октета ;
5). атомные (и ионные радиусы); 6). степень окисления.
Физический смысл химической периодичности
Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Графическим изображением периодического закона является периодическая таблица. Она содержит 7 периодов и 8 групп.
Периоды - горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов.
Номер периода соответствует числу энергетических уровней в атоме элемен-та.
Периоды могут состоять из 2-х (первый), 8-ми (второй и третий), 18-ти (четвертый и пятый) или 32-х (шестой, седьмой) элементов, в зависимости от количества электронов на внешнем энергетическом уровне. Все периоды (кроме первого) начинаются щелочным металлом (s-элементом), а заканчиваются благородным газом с полностью заполненными квантовыми орбиталями s- и р- подуровней (ns2 np6) внешнего слоя. Металлические свойства рассматриваются, как способность атомов элементов легко отдавать электроны, а неметаллические - присоединять электроны из-за стремления атомов приобрести устойчивую электронную конфигурацию. Заполнение внешнего s- подуровня указывает на металлические свойства атома, а формирование внешнего p- подуровня - на неметаллические свойства. Увеличение числа электронов на p- подуровне (от 1 до 5) усиливает неметаллические свойства атома. Атомы с полностью сформированной, энергетически устойчивой конфигурацией внешнего электронного слоя (ns2 np6) химически инертны. В больших периодах переход свойств от активного металла к благородному газу происходит более плавно, чем в малых периодах, т.к. происходит формирование внутреннего (n - 1) d- подуровня при сохранении внешнего ns2 подуровня. Большие периоды состоят из четных и нечетных рядов. У элементов четных рядов на внешнем слое ns2 - электроны, поэтому преобладают металлические свойства и их ослабление с ростом заряда ядра невелико; в нечетных рядах формируется np- подуровень, что объясняет значительное ослабление металлических свойств.
Группы - вертикальные столбцы элементов с одинаковым числом валентных электронов, равным номеру группы, различают главные (А) и побочные (В) подгруппы.
Главные подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены только на внешних ns- и np- подуровнях.
Побочные подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n - 1) d- подуровне (или (n - 2) f- подуровне). В зависимости от того, какой подуровень (s-, p-, d- или f-) заполняется валентными электронами, элементы периодической системы подразделяются на: s- элементы (элементы главной подгруппы I(А) и II(А) групп), p- элементы (элементы главных под-групп III(А) – VII(А)), d- элементы (элементы побочных подгрупп (В)), f- эле-менты (лантаноиды, актиноиды).
В главных подгруппах сверху вниз металлические свойства усиливаются, а неметаллические ослабевают. Элементы главных и побочных групп сильно отличаются по свойствам.
Общими для элементов главных и побочных подгрупп являются формулы высших оксидов (и их гидратов). У высших оксидов и их гидратов элементов I(А,В) – III(А,В) групп (кроме бора) преобладают основные свойства, с V(А,В) по VII(А,В) – кислотные (табл. 8).
Таблица 8
Формулы высших оксидов и гидроксидов
| Группа | I | II | III | IV | V | VI | VII | VIII (кроме инертных газов) |
| Высший оксид | Э2О | ЭО | Э2О3 | ЭО2 | Э2О5 | ЭО3 | Э2О7 | ЭО4 (OsO4) |
| Гидрат высшего оксида | ЭОН | Э(ОН)2 | Э(ОН)3 | Н2ЭО3 | Н3ЭО4 | Н2ЭО4 | НЭО4 | Н4ЭО4 |
Для элементов главных подгрупп общими являются формулы водородных соединений. Элементы главных подгрупп I(А) – III(А) образуют твердые вещества - гидриды (водород в степени окисления - 1), а IV(А) – VII(А) групп - газообразные. Водородные соединения элементов подгруппы IV(А) (ЭН4) - нейтральны, V(А) подгруппы (ЭН3) - основания, VI(А) и VII(А) подгрупп (Н2 Э и НЭ) - кислоты.
От положения элементов в периодической системе зависят свойства атома, связанные с его электронной конфигурацией: атомный радиус по периоду слева направо уменьшается, а в подгруппе сверху вниз возрастает. Согласно правилу октета, при движении по периодической таблице слева направо для отрыва электрона требуется больше энергии. Поэтому элементы с левой стороны таблицы стремятся потерять электрон, а с правой стороны – его приобрести. Двигаясь по периоду энергия ионизации плавно увеличивается слева направо.
Самая высокая энергия ионизации у инертных газов. Энергия ионизации уменьшается при движении вниз по группе, т.к. у электронов низких энергетических уровней есть способность отталкивать электроны с более высоких энергетических уровней. Это явление названо эффектом экранирования. Благодаря этому эффекту внешние электроны менее прочно связаны с ядром. Электроотрицательность – по периоду увеличивается, а в подгруппе сверху вниз уменьшается, следовательно, максимальной электроотрицательностью обладает атом фтора (F). Надо помнить, что благородные газы не имеют электроотрицательности.
Высшая валентность элемента (за исключением O, F, элементов подгруппы меди и восьмой группы) равна номеру группы, в которой он находится.
Неметалличность атома увеличивается с ростом заряда ядра в периодах, так как возрастает энергия сродства к электрону. В главных подгруппах с ростом заряда ядра нарастает металличность, так как энергия ионизации уменьшается. В связи с этим основные свойства оксидов ослабевают, а кислотные усиливаются в том же порядке — при движении слева направо и снизу вверх. При этом кислотные свойства оксидов тем сильнее, чем выше степень окисления образующего его элемента.
По периоду слева направо основные свойства гидроксидов ослабевают, по главным подгруппам сверху вниз сила оснований увеличивается. При этом, если металл может образовать несколько гидроксидов, то с увеличением степени окисления металла, основные свойства гидроксидов ослабевают.
По периоду слева направо увеличивается сила кислородосодержащих кислот. При движении сверху вниз в пределах одной группы сила кислородосодержащих кислот уменьшается. При этом сила кислоты увеличивается с увеличением степени окисления образующего кислоту элемента.
По периоду слева направо увеличивается сила бескислородных кислот, также она увеличивается и при движении сверху вниз в пределах одной группы.
Примеры решения типовых задач
| 4d |
| 5s |
| 1 |
| 2 |
| 3 4 5 6 7 |
| E |
Решение
| Рис. 4 Электронно-графическая схема атома |
б). Заполнить таблицу значений квантовых чисел для каждого электрона (табл.9), учитывая: 1) для s – подуровня орбитальное число равно l=0, для d – подуровня l=2; 2) магнитное квантовое число для s – подуровня имеет значение m = 0, для d – подуровня m: -2, -1, 0, +1, +2.
Таблица 9
Дата: 2018-11-18, просмотров: 2417.