I. Реакции образования комплексных соединений.
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение.
а) Образование гидроксокомплексов:
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl;
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl;
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4.
б) Образование комплексных солей.
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3;
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2.
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2.
II. Реакции обмена:
1) с участием ионов внешней сферы и образованием малорастворимых соединений, например:
а) 3K4[Fe(CN)6] + 4FeCl3 = Fe4[Fe(CN)6]3↓ + 12КCl, образуется малораство-
римое соединение – берлинская лазурь,
б) 2K3[Fe(CN)6] +3FeSO4 → Fe3[Fe(CN)6]2 ↓+ 3K2SO4, образуется малорас-
творимое соединение турнбулева синь;
2) реакции обмена лигандами или сменой кмплексообразователя, идущие с разрушением исходного комплексного иона и с образованием нового комплекса более устойчивого, с меньшей константой нестойкости:
а) [Cd(NH3)4]SO4 + 4KCN = K2[Cd(CN)4] + K2SO4 + 4NH3
КН ([Cd(NH3)4]2+) = 7,6∙10−8 > КН ([Cd(CN)4]2−) = 7,8∙10−18 ,
б) [Zn(NH3)4]SO4 + CuSO4 = [Cu(NH3)4]SO4 + ZnSO4
КН ([Zn (NH3)4]2+) = 3,5∙10−10 > КН ([Cu(NH3)4]2+) = 2,1∙10−13
II. Окислительно-восстановительные реакции.
Комплексные соединения могут участвовать в разнообразных окислительно-восстановительных процессах, если в состав комплексного иона и внешней среды входят ионы или молекулы с ярко выраженными окислительными или восстановительными свойствами, например:
а) 2K4[ 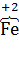 (CN)6] +
(CN)6] + 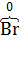 2 = 2K3[
2 = 2K3[ 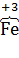 (CN)6] + 2K
(CN)6] + 2K 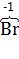 ,
,
| 2 |
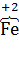 (CN)6]4−
(CN)6]4− 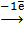 [
[ 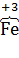 (CN)6]3−
(CN)6]3−
| 1 |
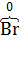 2
2 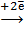 2
2 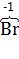
2[ 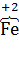 (CN)6]4− +
(CN)6]4− + 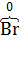 = 2[
= 2[ 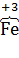 (CN)6]3− + 2
(CN)6]3− + 2 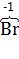 ;
;
б) 2Na[ 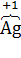 (CN)2] +
(CN)2] + 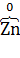 = Na2[
= Na2[ 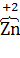 (CN)4] + 2
(CN)4] + 2 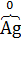
| 2 |
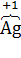 (CN)2]−
(CN)2]− 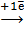
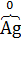 +2(CN)−
+2(CN)−
| 1 |
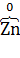 + 4(CN)−
+ 4(CN)−  [
[ 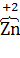 (CN)4]2−
(CN)4]2−
2[ 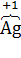 (CN)2]− +
(CN)2]− + 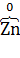 = 2
= 2 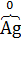 + [
+ [ 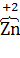 (CN)4]2−.
(CN)4]2−.
III. Реакции разрушения комплексных соединений.
1) Образование малорастворимого соединения с комплексообразователем:
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4;
2) образование малодиссоциированного электролита (например, H2O) :
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O;
3) действие любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O;
4) нагревание некоторых комплексных соединений:
[Cu(NH3)4]SO4 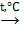 CuSO4 + 4NH3↑;
CuSO4 + 4NH3↑;
Na3[Al(OH)3] 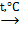 Na3AlO3 + 3H2O.
Na3AlO3 + 3H2O.
Примеры решения типовых задач
Пример 1. Назовите следующие комплексные соединения, координационные формулы которых:
а) Na2[Pt(CN)4Cl2]; б) [Cu(NH3)4](NO3)2; в) [Cu(H2O)4]SO4.
Решение.
а) дихлоротетрациано платинат (IV) натрия;
б) нитрат тетрааммин меди (II);
в) сульфат тетрааква меди (II).
Пример 2. Приведите уравнение химической реакции:
Cr2(SO4)3 + NaOH(ИЗБ.) →?
Решение.
Cr2(SO4)3 + 12NaOH(ИЗБ.) = 2Na3[Cr(OH)6] + 3Na2SO4.
Пример 3. Приведите координационную формулу соединения, имеющего брутто формулу: а) CoCl3 ∙3H2O; б) Ni SO4 ∙6 NH3; в) Zn(OH)2 ∙ 2 Na OH и назовите комплексное соединение.
Решение.
а) [Co(H2O)3Cl3] – трихлоротриаквакобальт (III);
б) [Ni(NH3)6] SO4 – сульфат гексаамминникеля (II);
в) Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия.
5.5. Коллоидные системы
Коллоидный раствор это субмикрогетерогенная система, состоящая из частиц дисперсной фазы (ДФ) и дисперсионной среды (ДС). При этом ДФ – фаза, которая распределяется, ДС – фаза в которой идет распределение. Если ДФ твердое вещество, то полученный коллоид имеет название золь. Устойчивое существование таких систем определяется двумя основными условиями: 1) ДФ и ДС должны быть взаимно нерастворимы друг в друге, 2) в системе должен присутствовать стабилизатор размера коллоидных частиц. Стабилизатором может являться электролит или высокомолекулярное вещество. Частицы коллоидного раствора, которые называются мицеллами, имеют размеры от 1 до 100 нм. По размерам своих частиц коллоидные растворы занимают промежуточное положение между грубодисперсными системами и истинными растворами, поэтому к получению веществ в коллоидном состоянии можно подойти с двух сторон: 1) получать их путем дробления крупных частиц ДФ до размеров 1 − 100 нм, 2) путем образования агрегата из отдельных молекул. Методы получения коллоидных растворов первым способом называются дисперсионными, а вторым – конденсационными. В некоторых случаях, когда молекула диспергированного вещества очень велика, коллоидный раствор может быть получен непосредственным растворением данного вещества в подходящем растворителе.
Диспергирование вещества осуществляется чаще всего в специальных коллоидных мельницах. Конденсационные методы можно осуществлять:
а) путем конденсации паров вещества; б) путем замены растворителя так, чтобы вещество из растворимого становилось практически нерастворимым;
в) путем химических реакций в растворах, сопровождающихся образованием малорастворимых веществ.
Свойства коллоидных растворов определяются главным образом размерами коллоидных частиц и возникающими на них зарядами. Особыми свойствами коллоидных систем являются: 1) оптические (светорассеяние - опалесценция и абсорбция – объемное поглощение световых волн); 2) молекулярно-кинетические (диффузия и седиментация); 3) электро-кинетические (электрофорез и электроосмос); 4) структурно-механические. Коллоидные мицеллы, представляя собой агрегаты (микрокристаллы) способные избирательно поглощать (адсорбировать) из окружающей среды те ионы, которые достраивают их кристаллическую решетку. Вследствие этого, коллоидные частицы заряжаются одноименно. На межфазной границе микрокристалл ДФ – ДС возникает двойной электрический слой (ДЭС).
Примером получения коллоидной системы может служить любая реакция, сопровождающихся образованием малорастворимых веществ:
AgNO3(избыток) + KI → AgI(нерастворим) + K NO3.
1) Ядро мицеллы (микрокристалл [m ∙AgI] с адсорбированными на нём потенциалопределяющими ионами (Ag+)):[m ∙AgI] n∙Ag+
2) Адсорбционная часть двойного электрического слоя (ДЭС), тонкая пленка ДС, содержащая некоторое количество противоионов 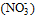 и прочно удерживаемая силами электростатического взаимодействия с потенциалопределяющими ионами: n∙Ag+ ∙ х и прочно удерживаемая силами электростатического взаимодействия с потенциалопределяющими ионами: n∙Ag+ ∙ х 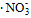 .
3) Диффузионная часть ДЭС (ионная атмосфера), содержащая противоионы .
3) Диффузионная часть ДЭС (ионная атмосфера), содержащая противоионы 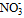 , необходимые для полной компенсации суммарного заряды потенциалопределяющих ионов: (n-x) , необходимые для полной компенсации суммарного заряды потенциалопределяющих ионов: (n-x) 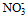 . .
|
| Рис. 16. Структура коллоидной мицеллы |
Электролит, находящийся в избытке является стабилизатором размера микрокристаллов. В данном случае это AgNO3, который при диссоциации дает ионы Ag+ и 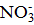 . Ионы Ag+ являются потенциалопределяющими и способны достраивать кристаллическую решетку микрокристалла AgI, при этом микрокристалл приобретает положительный заряд, а ионы
. Ионы Ag+ являются потенциалопределяющими и способны достраивать кристаллическую решетку микрокристалла AgI, при этом микрокристалл приобретает положительный заряд, а ионы 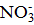 являются противоионами, компенсирующие заряд потенциалопределяющих ионов. У всех частиц данного коллоида появляется одноименный заряд (по зраку «+»), так же и ионная атмосфера у всех мицелл имеет один и тот же знак заряда («-»).
являются противоионами, компенсирующие заряд потенциалопределяющих ионов. У всех частиц данного коллоида появляется одноименный заряд (по зраку «+»), так же и ионная атмосфера у всех мицелл имеет один и тот же знак заряда («-»).
Схема структуры мицеллы приведена на рис. 16.
Формула мицеллы: {[ m ∙AgI]∙ n∙Ag+ ∙ х 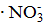 }(n-x)
}(n-x) 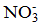 .
.
Ионные атмосферы (диффузионные части ДЭС) у всех мицелл данного золя заряжены одноименно, поэтому ядра мицелл не могут подойти друг к другу на расстояния действия сил сцепления. Чем шире ионная атмосфера, тем более устойчиво состояние коллоида. Любой фактор, вызывающий уменьшение ширины диффузионной части ДЭС, уменьшает устойчивость коллоида. Важной характеристикой коллоида является степень дисперсности (D), которая определяется как обратная величина размера коллоидной частицы (а):
D = 1/а. (73)
Коллоидные системы характеризуются двумя видами устойчивости: 1) агрегативной (т.е. способностью сохранять данный размер мицелл), 2) кинетической (способностью сохранять равномерное распределение ДФ по всему объему системы). Лишая коллоидные частицы заряда или уменьшая ширину диффузионной части ДЭС, можно вызвать потерю агрегативной устойчивости (частицы ДФ срастаются и укрупняются), а далее система теряет и кинетическую устойчивость (крупные частицы ДФ под действием сил тяжести начинают оседать − седиментировать). В данном случае идет разрушение золя с данной степенью дисперсности и перевод системы из разряда субмикрогетерогенных в грубодисперсные. Этот процесс называется коагуляцией. Коагуляцию может вызывать: введение в золь электролитов и золей противоположного заряда; увеличение концентрации золя; изменение температуры; разного рода механические воздействия (размешивание, встряхивание, взбалтывание) и т.д..
Наиболее важным и наиболее изученным фактором коагуляции гидрофобных золей является действие электролитов. Явная коагуляция золя наступает, когда количество электролита коагулянта превышает некоторое минимальное значение, и это минимальное количество электролита называется порогом коагуляции золя данным электролитом (γ, ммоль/л):
γ = (Сэл∙Vэл∙103)/Vзоля, (74)
где: Сэл, Vэл – молярная концентрация и объем электролита коагулянта, вызывающие коагуляцию, Vзоля – объем, коагулируемого золя.
Коагуляцию вызывает не весь электролит, а один из ионов. Ион коагулятор определяется по правилу Шульце-Гарди:
а) коагулирующим ионом электролита является тот ион, знак заряда которого противоположен знаку заряда потенциалопределяющих ионов;
б) коагулирующая сила ионов коагулянтов тем больше, чем выше их заряд;
в) коагулирующая сила ионов с одинаковой величиной заряда возрастает с увеличением радиуса иона.
Раздел 6
Дата: 2018-11-18, просмотров: 921.