| Кислоты | ||
| Одноосновные | Двуосновные | Трехосновные |
| HNO3 азотная | H2SO4 серная | H3 PO4 фосфорная |
| HF фтороводородная | H2SO3 сернистая | Н3AsO4 мышъяковая |
| HCl хлороводородная | H2S сероводородная | Н3ВО3 борная |
| HClO4 хлорная | H2CO3 угольная | |
| HI иодоводородная | H2SiO3 кремниевая | |
По способности к полной или частичной диссоциации молекул кислоты делятся на сильные (α = 100%) и слабые (α <100%), примеры в табл.3.
Таблица 3
Классификация кислот по степени диссоциации (α)
| Сильные кислоты (α=100%) | Слабые кислоты (α<100%) |
| H2SO4 серная | HF фтороводородная |
| HCl хлороводородная (соляная) | H2CO3 угольная |
| HNO3 азотная | H2SiO3 кремниевая |
| HClO4 хлорная | HCN циановодородная (синильная) |
| HMnO4 марганцовая | H2S сероводородная |
III . Основания
Основания – это сложные вещества, диссоциирующие в растворах с образованием гидроксильных ионов (ОН-), т.е. основные гидроксиды, или способные присоединять в реакциях ионы водорода (протоны.) Различные основания имеют разную способность отщеплять гидроксильные группы, поэтому их, подобно кислотам, подразделяют на сильные и слабые основания. Сильные основания в водных растворах склонны легко отдавать свои гидроксильные группы, а слабые – нет.
Неотъемлемым свойством оснований является способность взаимодействовать с кислотами, кислотными (а сильных оснований и с амфотерными оксидами и гидроксидами) с образованием солей: 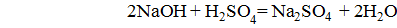 ;
;
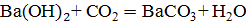 ;
;
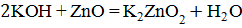 .
.
Основания классифицируют по следующим признакам:
а) по кислотности (по числу групп ОН— в молекуле основания):
1) однокислотные – LiOH, NaOH, KOH, т.е. гидроксида металлов I(А) группы и TlOH, называемые щелочами, в воде диссоциируют полностью: NaOH ↔ Na+ + OH-;
2) многокислотные – Ca(OH)2, Al(OH)3, Fe(OH)2, Fe(OH)3, Ni(OH)2 и др.,
многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 ↔ BaOH+ + OH-,
Ba(OH)+ ↔ Ba2+ + OH-;
б) по растворимости:
1) растворимые в воде основания называются щелочами; к ним относятся основания, которые образованы металлами I(А) группы - LiOH, NaOH и др. и щелочноземельными металлами - Са(ОН)2, Sr(ОН)2, Ва(ОН)2 и TlOH;
2) основания, образованные металлами других групп периодической системы в воде практически не растворяются, такие как:
Cu(OH)2, Al(OH)3, Mn(OH)2, Fe(OH)3 и др.;
в) по силе (по степени диссоциации α):
1) сильные (α = 100 %) – все растворимые в воде основания, образованные металлами I(А) группы - LiOH, NaOH и др., Ва(ОН)2, TlOH, малорастворимое основание Ca(OH)2;
2) слабые (α <100%) – все нерастворимые основания, например: Cu(OH)2, Fe(OH)3, Co(OH)3 и др., а также растворимое NH4OH;
г) по химическим свойствам:
1) проявляющие только основные свойства, например: Са(ОН)2, NaОН и др.;
2) проявляющие амфотерные свойства, например: Zn(ОН)2, Al(ОН)3,Сr(OH)3 .
IV . Соли
Если рассматривать соли как продукты частичного или полного замещения металлом протонов в кислотах или как продукты частичного или полного замещения гидроксильных групп в молекуле основания кислотными остатками, то можно выделить следующие типы солей:
а) средние соли – все атомы водорода в кислоте замещены металлом, примеры таких солей приведены в таблице 4, в которой, кроме того, приведено формирование названий солей;
Таблица 4
Дата: 2018-11-18, просмотров: 828.