Все окислительно-восстановительные реакции подразделяются на три класса:
1. Межмолекулярные реакции (атомы окислителя и восстановителя входят в состав различных веществ), например: 4FeSO4 + O2 + 2H2O= 4(FeOH)SO4,
где: FeSO4 − содержит восстановитель 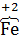 , O2 – является окислителем
, O2 – является окислителем 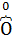 .
.
2. Внутримолекулярные (окислитель и восстановитель являются атомами различных элементов в составе одного соединения), например:
2Cu(NO3)2 = 2CuO +4NO2↑ + O2↑,
где: азот ( 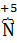 ), входящий в состав нитрата меди, является окислителем; кислород (
), входящий в состав нитрата меди, является окислителем; кислород ( 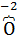 ) в нитрате является восстановителем.
) в нитрате является восстановителем.
3. Реакции диспропорционирования или самоокисления – самовосстановления (окислитель и восстановитель являются атомами одного и того же элемента в составе простого или сложного вещества), например: 4КClО3 = 3КClО4 + КCl,
где: часть атомов хлора ( 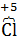 ), входящий в состав хлората калия является восстановителем и окисляется, переходя в высшую степь окисления (
), входящий в состав хлората калия является восстановителем и окисляется, переходя в высшую степь окисления ( 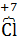 ) в перхлорате калия (КClО4), а оставшаяся часть атомов хлора (
) в перхлорате калия (КClО4), а оставшаяся часть атомов хлора ( 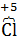 ), входящий в состав хлората калия является окислителем и при этом максимально восстанавливается
), входящий в состав хлората калия является окислителем и при этом максимально восстанавливается 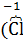 ), (КCl).
), (КCl).
Уравнения окислительно-восстановительных реакций описывают, используя методы электронно-ионного баланса, а также более простой в описании метод электронного баланса.
Алгоритм составления уравнения окислительно-восстановительных реакций:
1 этап
Схема реакции:
Mg + H2SO4(к) → MgSO4 + H2S + H2O
2 этап:
Определяем степени окисления элементов в исходных веществах и продуктах. Степень окисления это формальный заряд атома в сложном соединении, рассчитанный исходя из предположения, что все электроны химической связи смещены к более активному неметаллу. Степень окисления Mg, как простого вещества, равна нулю, степень окисления атома серы в составе молекулы серной кислоты равна +6. Степень окисления магния в составе продукта реакции сульфата магния (MgSO4) составляет +2, т.е. магний как простое вещество является восстановителем. Степень окисления серы в составе продукта сероводорода (H2S) составляет – 2, т.е. сера, входящая в состав серной кислоты является окислителем.
3 этап:
| 1 |
| 4 |
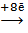 S-2
S-2
Mg0 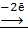 Mg+2
Mg+2
Суммарная реакция: S+6 + 4Mg0 → 4Mg+2 + S-2
4 этап:
Коэффициенты суммарного уравнения, как основные, переносим на молекулярное уравнение, расставляя остальные по закону сохранения масс:
4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O.
6.3 Гетерогенные окислительно-восстановительные процессы.
Электрохимические процессы
Электрохимические процессы – это окислительно-восстановительные процессы (ОВП) взаимного превращения химической и электрической форм энергии. Данные процессы можно разделить на два класса:
А) процессы, протекающие самопроизвольно, для которых изменение энергии Гиббса отрицательно (ΔG < 0) и в которых идет превращение химической энергии в электрическую, это процессы, идущие на электродах гальванических элементов;
В) процессы в электролизёрах, протекающие принудительно (ΔG > 0) под действием электрической энергии подведенной от внешнего источника к электродам, идет преобразование электрической энергии в энергию химическую.
Процессы окисления и восстановления в электрохимических системах пространственно разнесены. Окисление идет на электроде, который называется анодом, а восстановление протекает на катоде. Любая электрохимическая система состоит из проводников электрического тока двух родов:
1) проводники I рода с электронным типом проводимости, это кристаллические вещества (с металлическим типом химической связи), к ним относятся все металлы и аллотропная модификация углерода – графит (угольные электроды);
2) проводники II рода с ионным типом проводимости, это растворы, пасты или расплавы электролитов.
Электроды изготовляются из проводников I рода с электронным типом проводимости и вводятся в контакт с раствором или расплавом электролита (проводником II рода), на межфазной границе электрод – раствор (или расплав) электролита протекают окислительно-восстановительные процессы.
6.3.1. Гальванические элементы
Устройства, преобразующие химическую энергию ОВП в электрическую (процессы на электродах протекают самопроизвольно), называют химическими источниками электрического тока (ХИЭТ). Простейший ХИЭТ – гальваническая ячейка (гальванический элемент) – представляет собой систему из 2-х электродов, помещенные в растворы соответствующих электролитов, которые имеют между собой электролитический контакт (солевой мостик или электрохимически неактивную мембрану). На межфазной границе проводников I рода и II рода всегда возникает двойной электрический слой, характеризующийся разностью электростатических потенциалов. При равновесии скорость растворения
металла равна скорости восстановления его ионов из раствора. Скачок потенциала, возникающий в двойном электрическом слое при равновесии, называется равновесным потенциалом данного металла (металлического электрода) в данных условиях: φ ( 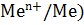 . Если определение потенциала проводилось при стандартных условиях (Т=298К, Р=101,3 кПа), то значение потенциала является стандартным φ0 (
. Если определение потенциала проводилось при стандартных условиях (Т=298К, Р=101,3 кПа), то значение потенциала является стандартным φ0 ( 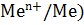 (см. в справочниках физико-химических величин).
(см. в справочниках физико-химических величин).
При этом на межфазной границе устанавливается подвижное окислительно-восстановительное равновесие:
Mе + mH2О ⇄ Меn+∙ mН2О + nē.
При замыкании электродов металлическим проводником, образующим внешнюю цепь электрохимической системы на электродах начинается направленный окислительно-восстановительный процесс.
Схема любого химического источника тока имеет электрохимическую запись, которая отражает современную систему обозначений для гальванических элементов.
Как пример, можно рассмотреть работу ртутно – кадмиевого гальванического элемента, в основе работы которого лежит токообразующая реакция: Cd + Hg(NO3)2 = Cd(NO3)2 + Hg.
Схема гальванического элемента:
(А) (–)Cd│Cd(NO3)2║ Hg(NO3)2│ Hg(+)(К).
Значения стандартных электродных потенциалов: φ0 ( 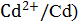 = − 0,40 В;
= − 0,40 В;
φ0 ( 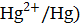 = + 0,85 В
= + 0,85 В
Слева записывается система (полуэлемент Cd 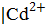 ), имеющая меньшее значение стандартного электродного потенциала и являющаяся анодом. Справа записывается катодная система с большим потенциалом (
), имеющая меньшее значение стандартного электродного потенциала и являющаяся анодом. Справа записывается катодная система с большим потенциалом ( 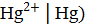 . При замыкании внешней цепи на электродах направлено идут процессы:
. При замыкании внешней цепи на электродах направлено идут процессы:
| 2 1 2 1 |
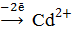
б) на катоде – восстановление 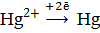
Cd + 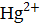 =
= 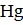 +
+ 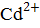 .
.
Количество электронов перемещенных от восстановителя к окислителю равно двум, n = 2. Процесс окисления материала анода приводит к тому, что на кристаллической решетке металла (в данном случае кадмиевого электрода) возникает избыток электронов, и материал анода заряжается отрицательно. На катоде за счет восстановления дополнительного количества ионов металла идет уменьшение электронного газа в материале катода, и катод заряжается положительно. Вертикальная черта в схеме элемента обозначает межфазную границу. Двойная вертикальная линия разделяет анодную и катодную системы. В круглых скобках знаками плюс и минус обозначают полюсы электродов.
Влияние различных факторов на величину электродного потенциала любого электрода выражается уравнением Нернста:
φOx/Red = φ0Ox/Red + 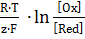 , (78)
, (78)
где: φ0Ox/Red – значение стандартного электродного потенциала (см. в справочнике), определяется природой электрода; Т– температура К; R – газовая постоянная (8,31∙10-3 кДж/(моль∙ К)); z – количество электронов, участвующих в электродном процессе; F – постоянная Фарадея (96500 Кл/моль); [Ox],[Red] – концентрации окисленной и восстановленной форм данной окислительно-восстановительной системы. Если условия привести к стандартным, подставить значения всех постоянных и перевести натуральный логарифм в десятичный, то уравнение Нернста имеет вид:
φOx/Red = φ0Ox/Red + 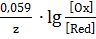 . (79)
. (79)
В гетерогенных системах концентрация конденсированных фаз (кристаллических) есть величина постоянная (условно принятая за 1). Поэтому в гальванических элементах составленных из двух полуэлементов: металлических электрод – раствор соли данного металла, концентрация восстановленной формы окислительно-восстановительной системы равна единице, [Red]=1. Уравнение Нернста для металлических электродов в рассматриваемом примере имеет вид:
а) для анода 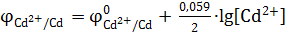 ,
,
б) для катода 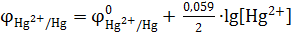 .
.
Следовательно, в стандартных условиях потенциал электрода будет определяться материалом электрода (природой металла), составом и концентрацией раствора (расплава) электролита, в который помещен электрод.
Важной количественной характеристикой гальванического элемента как источника тока является электродвижущая сила (ЭДС), измеряемая в вольтах (Е, В). ЭДС определяется как максимальная разность потенциалов катода и анода при разомкнутой внешней цепи: Е = φкатод – φанод.
Изменение энергии Гиббса определяется:
ΔG = – n∙ F∙ E (Дж/моль). (80)
6.3.2. Электролиз
Электролиз это совокупность принудительных процессов восстановления на катоде и окисления на аноде под действием электрического тока, подведенного от внешнего источника и протекающего через раствор или расплав электролита, находящийся в электролизёре.
На катод от внешнего источника подается поток электронов, при этом материал катода является источником электронов, т.е. катод при электролизе это отрицательно поляризованный электрод, на поверхности которого происходит процесс восстановления. В процессе электролиза под действием градиента потенциала из материала анода на внешний источник отводится часть электронного газа, при этом материал анода поляризуется положительно. На аноде возможны только процессы окисления, в том числе и самого материала электрода, такие аноды называются активными. Материалом таких анодов являются все металлы за исключением золота (Au) и платины (Pt). Если материал анода не окисляется, то такие электроды называются инертными, например, графитовые (угольные) электроды. Процессы, протекающие на электродах при электролизе, подчиняются общим правилам окислительно-восстановительных процессов.
Правило катодного восстановления: на катоде в первую очередь восстанавливается из системы тот окислитель, который имеет максимальное значение потенциала.
Правило анодного окисления: на аноде в первую очередь окисляется тот восстановитель, который имеет минимальное значение потенциала.
В качестве примера можно рассмотреть процесс электролиза (с использованием инертных электродов) водного раствора смеси электролитов: КCl, Cu(NO3)2, H2SO4. При растворении в воде каждый электролит диссоциирует на соответствующие ионы, причем, каждый ион имеет гидратную оболочку:
а) КCl + mH2О→ К+∙хH2О + Cl‾∙уH2О;
б) Cu(NO3)2 + nH2О → Cu2+∙zH2О +2(NO3)‾∙qH2О;
в) H2SO4 + fH2О → 2Н+∙jH2О + (SO4)2- ∙kH2О.
| К+∙хH2О Cu2+∙zH2О Н+∙jH2О |
| + |
| ─ |
| nē |
| nē |
| Рис. 18. Схема электролиза |
| Cl‾∙уH2О (NO3)‾∙qH2О (SO4)2- ∙kH2О |
Таблица 12
Дата: 2018-11-18, просмотров: 859.