6.1. Важнейшие окислители и восстановители, их количественные характеристики
Окислительно-восстановительными называются реакции, идущие с изменением степеней окисления атомов, входящих в состав реагирующих веществ. Под степенью окисления атома (с.о.) понимают тот эффективный заряд, который имел бы атом, если бы электроны химической связи полностью переместились к более электроотрицательному элементу.
Степень окисления меняется при отдаче или принятии электрона, поэтому окислительно-восстановительным реакциям можно дать определение:
Окислительно-восстановительные– это реакции, в которых электроны переходят от одних частиц к другим.
Процесс потери атомом электронов называется окислением, а процесс присоединения – восстановлением.
Вещества, теряющие электроны - восстановители, а вещества, присоединяющие электрон - окислители.
В главных подгруппа, где располагаются элементы – электронные аналоги, восстановительная способность с ростом радиуса атома растет:
Li, Na, K, Rb, Cs, Fr.
¾¾¾¾¾¾¾¾¾¾¾¾®
Растет восстановительная способность
В периоде с ростом заряда ядра восстановительная способность падает, так как растет число электронов на внешнем уровне при практически неизменном радиусе:
Li, Be, B, C, N, O, F – II период
¾¾¾¾¾¾¾¾¾¾¾¾®
Падает восстановительная способность
Окислительная способность изменяется в обратном направлении, то есть в главных подгруппах с ростом радиуса падает, а в периоде – растет. Самый сильный окислитель – фтор.
Многообразие химических реакций подразделяется на два типа:
1. Реакции обменного характера, проходящие без изменения степеней окисления элементов, входящих в состав молекул реагирующих соединений.
2. Окислительно-восстановительные процессы (ОВП), вследствие которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ.
Степень окисления это эффективный заряд атома в молекуле; условно степень окисления элемента в соединении определяется как число электронов смещенных от атома данного элемента к другим атомам или от других атомов на атом данного элемента. При вычислении степени окисления элемента в соединении исходят из следующих положений:
1. степень окисления элемента в простом веществе равны нулю;
2. суммарный заряд молекулы равен нулю;
3. постоянную степень окисления проявляют элементы I(А)(+1) и II(А)(+2) групп, цинк и кадмий ( 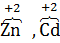 );
);
4. водород имеет степень окисления +1 во всех соединениях, кроме гидридов активных металлов, в которых степень окисления его равна −1;
5. степень окисления кислорода в соединениях равна −2, за исключением пероксидов (− 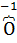 −
− 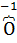 −) и фторида кислорода
−) и фторида кислорода 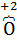 F2.
F2.
При этом окислитель – элемент в составе простого или сложного вещества, который получает электроны, снижая свою степень окисления, т.е. восстанавливается. Восстановитель – элемент, который теряет электроны, повышая свою степень окисления, т.е. окисляется. Все окислители и восстановители можно определить по следующим основным характеристикам:
Окислители:
1. Материал анода (с дефицитом электронов), подключенный к внешнему источнику электрического тока.
2. Атомы элементов в высших степенях окисления –  .
.
3. Атомы элементов в промежуточных степенях окисления по отношению к сильным восстановителям - 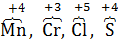 .
.
4. Элементарные неметаллы, в особенности, имеющие высокие значения электроотрицательности – F2, Cl2, O2, Br2.
Восстановители:
1. Избыток электронов на материале катода, подключенного к внешнему источнику электрического тока.
2. Ионы элементов в низших степенях окисления – 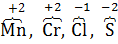 .
.
3. Атомы элементов в промежуточных степенях окисления по отношению к сильным окислителям - 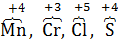 .
.
4. Элементарные металлы как простые вещества, которые могут иметь только положительную степень окисления.
Количественной характеристикой окислительно-восстановительной активности элементов является величина стандартного окислительно-восстановительного потенциала, измеряемого в вольтах (φ0Ox/Red).
Чем больше значение окислительно-восстановительного потенциала системы, тем более активный окислитель находится в данной системе. Чем меньше значение окислительно-восстановительного потенциала, тем более активный восстановитель находится в данной системе.
Значения стандартных окислительно-восстановительных (электродных) потенциалов определены экспериментально относительно значения стандартного потенциала базовой системы – водородного электрода в стандартном состоянии, на котором протекает процесс:
2Н+р-р 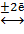 Н2(г) .
Н2(г) .
Стандартный потенциал базовой системы равен нулю φ0(2Н+р-р/ Н2(г))=0,00 В.
Значения стандартных окислительно-восстановительных (электродных) потенциалов всех окислительно-восстановленных систем, измеренные в стандартных условиях, приводятся в справочниках физико-химических величин. Значения стандартных электродных потенциалов систем: металл – раствор, содержащий простые катионы данного металла, использованы при построении ряда напряжений Бекетова, где металлы располагаются в порядке убывания восстановительной активности, в этом ряду содержится стандартный потенциал базовой системы (окисление-восстановление водорода) φ0(2Н+р-р/ Н2(г))=0,00 В.
Основным условием возможности протекания окислительно-восстановительно-
го процесса является отрицательное значение изменения изобарно-изотерми-ческого потенциала (ΔG < 0), которое определяется электрической работой (А) по переносу заряда в пространстве:
ΔG = –А, (75)
А = n∙ F∙ E, (76)
Е = φокислитель – φвосстановитель, (77)
где: n – величина заряда перемещенного в пространстве (количество передаваемых в элементарном процессе электронов); F – постоянная Фарадея (96500 Кл/моль); E – максимальная разность потенциалов между точками переноса заряда (электродвижущая сила). Отрицательное значение изменения изобарно-изотермического потенциала (ΔG < 0) может быть только при условии:
φокислитель > φвосстановитель.
Самопроизвольно окислительно-восстановительный процесс может протекать только в сторону уменьшения потенциала окислителя.
Дата: 2018-11-18, просмотров: 856.