| Кислота, образующая соль | Кислотный остаток | Примеры и название солей |
| HNO3 азотная | NO3- нитрат | NaNO3 нитрат натрия, Al(NO3)3 нитрат алюминия |
| H2SO4 серная | SO42- сульфат | PbSO4 сульфат свинца, NiSO4 сульфат никеля, Al2(SO4)3 сульфат алюминия |
| H3PO4 фосфорная | PO43- фосфат | Са3(РО4)2, К3РО4 фосфаты кальция, калия |
| H2CO3 угольная | CO32- карбонат | Na2CO3, ВаСО3 карбонаты натрия, бария |
| H2SiO3 кремниевая | SiO32-силикат | Li2SiO3, SrSiO3 силикаты лития, стронция |
| H2SО3 сернистая | SО3 2- сульфит | Na2SO3, ВаSО3 сульфиты натрия, бария |
| HCl хлороводородная (соляная) | Cl- хлорид | NH4Cl хлорид аммония, ZnCl2 хлорид цинка |
| HF фтороводородная (плавиковая) | F- фторид | CaF2 фторид кальция, AlF3 фторид алюминия |
| HCN циановодородная (синильная) | CN– цианид | КCN цианид калия, Ba(CN)2 цианид бария |
| H2S сероводородная | S2- сульфид | СuS сульфид меди, FeS сульфид железа (II) |
б) кислые соли – продукты частичного замещения катионов водорода многоосновных кислот на катионы металла. Они образуются при нейтрализации основания избытком кислоты. Названия кислых солей образуются путём добавления приставки гидро- к названию аниона. Если на один анион приходится больше одного атома водорода, то его количество указывают при помощи умножающей приставки, например: NaHCO3 (гидрокарбонат натрия), NaH2PO4 (дигидрофосфат натрия), NaНSO3 (гидросульфит натрия).
в) Основныесоли можно рассматривать как продукты неполного замещения гидроксильных групп многокислотных оснований кислотными остатками. Они образуются в условиях избытка основания или недостатка кислоты. Для образования названий основных солей используется приставка гидроксо - к названию аниона. Если на один анион приходится больше одной гидроксогруппы, то количество ОН- указывают при помощи умножающей приставки: Fe(OH)NO3 (гидроксонитрат железа(II)), Fe(OH)2Cl (дигидроксохлорид железа(III).
По виду и количеству присутствующих в структуре соли катионов и анионов можно выделить следующие типы солей:
1) простые соли — соли, состоящие из одного вида катионов и одного вида анионов, например: CaF2 (фторид кальция), Na2CO3 (карбонат натрия);
2) двойные соли – атомы водорода многоосновной кислоты замещены не одним металлом, а двумя различными, одним из которых может являться катион аммония NH4+, например: NaKCO3 (карбонат натрия калия) , KAl(SO4)2 (сульфат алюминия калия – алюмокалиевые квасцы) , NH4Fe(SO4)2 (сульфат железа (III)аммония – железоаммонийные квасцы) и т.д.;
3) смешанные соли — соли, в составе которых присутствует два различных аниона, например: CaCl(OCl)) – кальциевая соль соляной (HCl) и хлорноватистой (HOCl) кислот (хлорид-гипохлорит кальция);
4) комплексные соли – соли, в составе которых присутствуют комплексные катионы [Ni(NH3)6]CI2 или комплексные анионы K2[Cd(CN)4].
Основные законы химии
I . Закон сохранения массы вещества, сформулированный и доказанный М.В. Ломоносовым в 1748 году, гласит: масса веществ, вступивших реакцию, равна массе веществ, образовавшихся в результате реакции. Закон сохранения массы вещества является частным случаем закона сохранения материи и лежит в основе всех количественных расчетов.
II . Закон постоянства состава, сформулированный Прустом в 1808 году, утверждает.
Всякое чистое вещество независимо от способа получения имеет постоянный качественный и количественный состав.
III . Закон Авогадро.
В равных объёмах различных газов при одинаковых условиях ( P , T - const ) содержится одинаковое число молекул. Закон Авогадро имеет два следствия.
1) Один моль любого газа при одинаковых условиях занимает один и тот же объём. Установлено, что объём 1моль любого газа при нормальных условиях (нормальными условиями (н.у.) считают давление P = 101,325∙103 Па и температуру Т= 273 К) составляет 22,4 литра (22,4∙10-3 м3). Эта величина называется молярным объёмом и обозначается Vm = 22,4 л/моль.
2) Массы (m, г) равных объемов двух газов (V1=V2), взятых при одинаковом давлении и температуре, относятся друг к другу как их молярные массы (M, г/моль):
m1/m2 = M1/M2 ( 2 )
Отношение m1/m2 называется относительной плотностью (D) первого газа (1) по второму (2), т.е. газу определителю (эталонному) с известной молекулярной массой (М2),
D = m1/m2 ( 3)
Величина D определяется экспериментально. По величинам D и М2 можно найти молярную массу исследуемого газа:
М1 = D∙М2. (4)
В качестве эталона наиболее часто используются водород ( 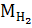 = 2 г/моль) и воздух (Мвозд. = 29 г/моль).
= 2 г/моль) и воздух (Мвозд. = 29 г/моль).
IV . Закон простых объемных отношений.
Простые вещества и химические соединения могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Гей-Люссак (французский химик) в 1805-1808 г.г. занимался изучением реакций в газовой фазе, проводил опыты по измерению объемов газов в химических реакциях, в результате чего сформулировал закон:
Объемы вступающих в реакцию газов относятся друг к другу, а также к объемам получающихся газообразных продуктов как небольшие целые числа. Все объемы должны быть измерены при одинаковой температуре и давлении или приведены к одним и тем же условиям.
V . Закон кратных отношений
Если два элемента образуют друг с другом несколько соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся как небольшие целые числа.
Например: если подсчитать массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании оксида углерода (II) СО и диоксида углерода СО2, разделив друг на друга величины, выражающие содержание кислорода и углерода в том и в другом оксидах (mкислород/mуглерод), то получится, что на одну единицу массы углерода в оксиде углерода (IV) приходится ровно в 2 раза больше кислорода, чем в оксиде углерода (II). Число единиц массы кислорода, приходящихся на одну единицу массы углерода – N (табл. 5).
Таблица 5
Пример закона кратных отношений
| Химическое соединение | mкислород/mуглерод | N |
| Оксид углерода (II) СО | 1,33 | 1 |
| Оксид углерода (IV) СО2 | 2,66 | 2 |
VI. Закон эквивалентов
Все вещества взаимодействуют между собой в количествах, пропорциональных их химическим эквивалентам (Э).
Например: реакция 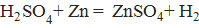 , математическое выражение закона эквивалентов к данной реакции:
, математическое выражение закона эквивалентов к данной реакции:
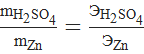 или
или 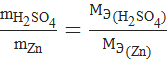 . (5)
. (5)
Эквивалент (Э) – это реальная или условная частица, которая взаимодействует с 1 моль атомов водорода в кислотно-основных превращениях или 1 моль электронов в окислительно-восстановительных реакциях. Число, показывающее какая доля реальной или условной частицы соответствует 1 эквиваленту называется фактором эквивалентности ( fэ). Фактор эквивалентности = 1 или < 1.
Число эквивалентности {\displaystyle z} (z) представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моле этого вещества. Фактор эквивалентности (fЭ) связан с числом эквивалентности следующим соотношением: 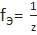 .
.
Значение числа эквивалентности (z) зависит от природы реагирующих веществ и типа реакции:
а) для химического элемента в соединении – z = B,
где: В – валентность элемента;
б) для кислоты – z кислоты = основность кислоты;
в) для основания – z основания = кислотность основания;
г) для соли – z соли = В∙n,
где: В – валентность катиона, n – количество катионов в соли;
д) для оксида – zоксида= n ∙В,
где: n – количество атомов элемента, В – валентность элемента.
Молярная масса эквивалента ( M э) – это масса одного моль эквивалента, она измеряется в г/моль и равна произведению молярной массы вещества на фактор эквивалентности.
МЭ = М∙fЭ, (6)
Эталонными эквивалентами , а также эталонными молярными массами эквивалентов являются эквиваленты и молярные массы эквивалентов водорода и кислорода: МЭ(Н) = 1 г/моль, МЭ(О) = 8 г/моль. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов образующих его составных частей:
Мэ (оксида) = Мэ (элемента) + Мэ (О), или МЭ(оксида) = М/ zоксида
МЭ(кислоты) = МЭ(Н) + МЭ(кислотного остатка) или МЭ(кислоты) = М(кислоты) / zкислоты
МЭ(основания) = МЭ(Ме) + МЭ(ОН) или МЭ(основания) = М(основания) / zоснования
Мэ (соли) = Мэ (Ме) + Мэ (кислотного остатка) или Мэ (соли) = М(соли) /z (соли)
Газообразные вещества помимо молярной массы эквивалента имеют молярный объем эквивалента (VЭ, л/моль) – объем, занимаемый молярной массой эквивалента или объем одного моль эквивалента, который при нормальных условиях равен 11,2 л/моль для водорода и 5,6 л/моль для кислорода.
VII . Объединенный закон Бойля – Мариотта, Гей – Люссака и Шарля: ( P0V0)/ T0 = const., ( P0V0)/ T0=( PV)/ T, (7)
где: P0 = 101,3 кПа (нормальное давление), V0 – л, объем газа при нормальных условиях (приведенный объем), T0 – 273K (нормальная температура, шкала Кельвина), Р, V, Т – параметры, имеющие значения отличные от нормальных.
Уравнение Клапейрона-Менделеева
Если записать объединенный газовый закон для любой массы любого газа, то формула примет вид:
РV= (m / M) RT, (8)
где: m - масса газа г; M - молекулярная масса г/моль ; Р – давление кПа; V – объем л; T - абсолютная температура (°К); R - универсальная газовая постоянная равная 8,314 Дж/(моль ∙ К).
Для данной массы конкретного газа отношение m / M постоянно, поэтому уравнение Клапейрона-Менделеева преобразуется в объединенный газовый закон.
VIII. Закон Дальтона
Общее давление газовой смеси (Робщ) является суммой парциальных давлений (Рi) ее компонентов:
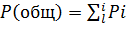 . (9)
. (9)
Парциальное давление любого компонента газовой смеси это давление, которое производил бы этот компонент, если бы он занимал тот же объём, что и вся смесь газов, при той же температуре. Мольная доля (Ni) и объемная доля (Nоб) отдельных компонентов в газовой смеси может быть выражена: Ni = Рi / Робщ; Ni = ni / Σn; Nоб = Vi/ Vобщ,
где: ni – количество моль любого компонента газовой смеси; Σn – общее число моль газовой смеси; Vi – парциальный объем газового компонента; Vобщ - общий объем газовой смеси.
Мольная доля отдельного компонента в газовой смеси равна объёмной доле этого компонента в газовой смеси.
{\displaystyle x_{\mathrm {i} }={\frac {P_{\mathrm {i} }}{P}}={\frac {n_{\mathrm {i} }}{n}}}Примеры решения типовых задач
Пример 1. Какой объем при н.у. занимают: а) 0,5 моль водорода; б) 32 г оксида азота (II)?
Дано:
n(H  )= 0,5 моль;
m(NO)= 32 г;
V0 (m) = 22,4 л/моль )= 0,5 моль;
m(NO)= 32 г;
V0 (m) = 22,4 л/моль
| Решение
На основании закона Авогадро (I следствие)
а) V0 (H  ) = n(H ) = n(H 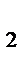 )∙V0(m), V0 (Н )∙V0(m), V0 (Н 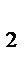 ) = 0,5 ∙22,4 = 11,2 л
б) n (NO) = ) = 0,5 ∙22,4 = 11,2 л
б) n (NO) = 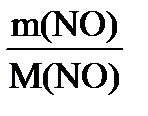 ; n (NO) = ; n (NO) = 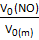
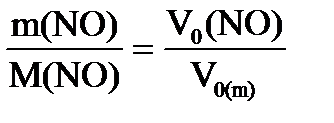 ; M (NO) = 30 г/моль; V0 (NO) = ; M (NO) = 30 г/моль; V0 (NO) = 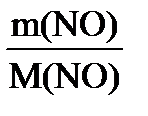 ∙ V0 (m) ; V0 (NO) = ∙ V0 (m) ; V0 (NO) = 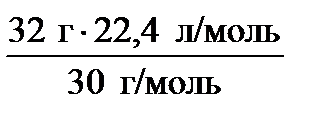 = 23,9 л. = 23,9 л.
|
Найти: V0 (H  )}?
V0 (NO)}? )}?
V0 (NO)}?
| Ответ: V0(H2) = 11,2 л; V0(NO) = 23,9 л |
Пример 2. Вычислите объем, занимаемый 7 г оксида углерода (II) при 70C и 103974 Па.
| Дано: m(СO)= 7 г; t = 70C = (7+273) =280К; Т=280К; Р(СО) = 103974 Па; М(СО) = 28 г/моль | Решение
На основании уравнения Клапейрона – Менделеева:
P(СО)∙ V(СО) = 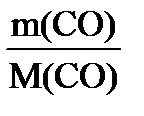 RT,
V(СО)= RT,
V(СО)= 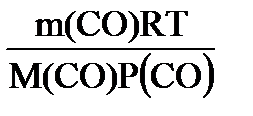 = = 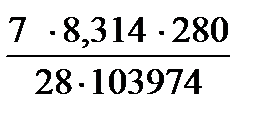 =0,0056 м =0,0056 м 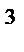 = 5,6 л
= 5,6 л
|
| Найти: V(CO) }? | Ответ: V(СО) = 5,6 л. |
Пример 3. Определите парциальные давления азота и кислорода в смеси объемом 7л, если общее давление в смеси равно 8,2 МПа, а объемы смешиваемых газов равны 2л и 5л соответственно.
| Дано: Vсм (N2+O2) = 7 л; Робщ. = 8,2 МПа; V(N2) = 2 л; V(О2) = 5 л | Решение На основании закона Дальтона: а)объемные доли газовых компонентов определяются:Nоб = Vi/ Vобщ. Nоб(N2)= 2/7, Nоб(О2)= 5/7; б) парциальные давления газов: Рi = Nоб(i)∙ Робщ Р(N2) = (2/7)∙8,2 = 2,34 МПа, Р(О2) = (5/7)∙8,2 = 5,86 МПа. | |
| Найти: парциальные давления: Р(N2)}? Р(О2)}? | ||
| Ответ: P (N2) = 2,34 MПа, P (O2) = 5,86 МПа. |
Пример 4. Двухвалентный металл массой 0,604 г вытеснил из кислоты 581 мл водорода, собранного над водой при 18 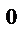 С и давлении 105,6 кПа. Давление насыщенного водяного пара при 18
С и давлении 105,6 кПа. Давление насыщенного водяного пара при 18 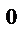 С составляет 2,1 кПа. Найдите молярную массу эквивалента металла, укажите металл.
С составляет 2,1 кПа. Найдите молярную массу эквивалента металла, укажите металл.
| Дано: m(Me) = 0,604 г В = 2 V(H2) = 581 мл = 0,581 л t = 18 Т = (273+18)К h = 2,1 кПа Р = 105,6 кПа н. у.: VЭ(H2)=11,2 л Т0 = 273К Р0 = 101,3 кПа | Решение
Схема процесса: Ме + 2HCl → MeCl 2 + H2
На основании объединенного газового закона с поправкой на давление водяного пара
находим объем выделившегося водорода при н.у. : V0 (H 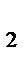 ) = ) = 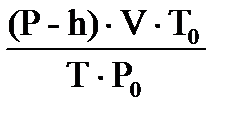 = = 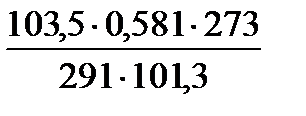 =0,557л.
Согласно закону эквивалентов =0,557л.
Согласно закону эквивалентов 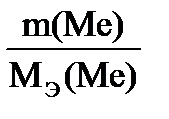 = = 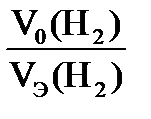 МЭ(Ме) =
МЭ(Ме) = 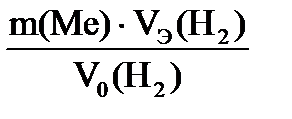 = = 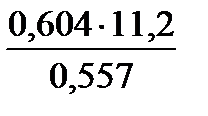 = 12,15 г/моль. Молярная (атомная, А) масса металла определяется:
А(Ме) = В∙ МЭ(Ме) = 2∙12,15 = 24,3 г/моль. = 12,15 г/моль. Молярная (атомная, А) масса металла определяется:
А(Ме) = В∙ МЭ(Ме) = 2∙12,15 = 24,3 г/моль.
| |
| Ответ: искомый металл – магний Mg
| ||
| Найти: МЭ(Ме) - ? А(Ме) -? |
Пример 5. При сжигании 1,635г цинка в струе кислорода получено 2,035г оксида цинка. Вычислите молярную массу эквивалента цинка.
| Дано: m(Zn) = 1,635 г m(ZnО) = 2,035 г МЭ(О) = 8 г/моль | Решение Уравнение процесса: 2Zn + О2 = 2ZnО, 1) Масса кислорода в оксиде: m(O) = m(ZnO) – m(Zn) = 2,035г – 1,635г = 0,400 г. 2) Закон эквивалентов: m(Zn)/m(O) = MЭ(Zn)/ MЭ(О), МЭ(Zn) = | |
| Найти: МЭ(Zn) -? | ||
| Ответ: МЭ(Zn) = 32,7 г/моль |
Контрольные вопросы и задания
Вариант 1.
1. Что такое явление аллотропии и чем оно вызвано?
2. Какое количество атомарного кислорода содержится в угольной кислоте количеством 1 моль?
3. Руда содержит 90% FeS2 и 10% FeAsS. Найдите массу серы, содержащейся в 1 тонне руды.
4. Какой объём газа, измеренный при нормальных условиях, выделится при растворении алюминия массой 10,8 г в избытке раствора соляной кислоты?
5. Выведите формулу кристаллогидрата хлорида бария, если известно, что при прокаливании 36,6г соли потеря в массе составляет 5,4г.
Вариант 2
1. Одинаковое ли число молекул в 0,5г азота и 0,5г метана?
2. Выведите формулу кристаллогидрата фосфата натрия, если известно, что массовая доля соли в нём составляет 84,2% ?
3. Определите плотность по водороду газовой смеси, состоящей из 56л аргона и 28л азота.
4. Какие массы алюминия и оксида железа (Fe2O3) следует взять для получения железа массой 140г ?
5. Оксид углерода (IV), полученный при сжигании угля массой 50г, пропустили через раствор гидроксида бария. Какая масса осадка образовалась, если массовая доля углерода в угле составляет 90%?
Вариант 3
1. Что называется относительной атомной массой? Укажите относительные атомные массы азота, хрома и железа.
2. Какое количество атомарного бора содержится в 2 моль тетрабората натрия (Na2B4O7)?
3. Определите плотность по водороду аммиака.
4. Какой объём водорода может быть получен при действии на 20г цинка 100мл 30% раствора соляной кислоты?
5. Выведите истинную формулу углеводорода, плотность которого по водороду составляет 15, а массовое соотношение углерода к водороду составляет 4:1.
Вариант 4
1. Дайте определение понятию моль. Сколько частиц содержит:
а)1 моль атомов водорода; б)1 моль молекул кислорода; в)1 моль ионов хлора?
2.Определите плотность по водороду паров гексана (C6H14).
3. Выведите истинную формулу вещества, содержащего 93,75% углерода и 6,25% водорода, если плотность его по воздуху составляет 4,41.
4. Какую массу оксида кальция, можно получить при прокаливании 1тонны известняка, содержащего 80% карбоната кальция?
5. Сплав содержит 85% магния и 15% меди. Навеску сплава массой 8,52г обработали избытком соляной кислоты. Вычислите объём (при н.у.) выделившегося газа.
Вариант 5
1. Какое количество атомарного бора содержится в 0,5моль тетрабората натрия (Na2B4O7)?
2. Выведите истинную формулу вещества, содержащего 60% углерода 35,55% кислорода и 4,45% водорода, если плотность вещества по водороду составляет 90.
3. Сколько литров кислорода ( при н.у.) потребуется для сжигания 100г нафталина (C10H8)?
4. Некоторый сплав содержит 83% и 17%. Навеску сплава массой 8,34г обработали водным раствором щелочи, при этом выделился газ, какой и в каком объёме? (рассчитайте при н.у.)/
5. Вычислите объём, занимаемый водородом при нормальных условиях, если при 200С и 104,5 кПа газ занимает объём 300 мл.
Вариант 6
1. В реакции между азотом и кислородом объем реакционной системы не изменяется. Какой оксид получается в результате реакции?
2. Масса 1л воздуха при 101,33 кПа и 20 градусах по Цельсию равна 1,2г. Вычислите среднюю мольную массу воздуха.
3. Вычислите сколько азота содержится в 1 кг следующих соединений: 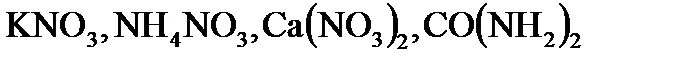 .
.
4. При растирании иода с порошком железа образуется вещество, в котором на три атома железа приходится восемь атомов иода. Считая, что железо находится в двух- и трехвалентном состоянии, выведите формулу этого соединения.
5. Сплав содержит 85% магния и 15% алюминия. Навеску 8,52г сплава обработали хлороводородной кислотой. Вычислите объем выделившегося водорода при н. у.
Вариант 7
1. Минерал изумруд содержит, в %,: 2,3 H; 14,2 P; 24,8 Al; 58,7 O и примеси меди, определяющие окраску. Выведите простейшую формулу изумруда. Запишите формулу минерала в виде формул оксидов.
2. Масса 1 л азота при н.у. равна 1,251 г. Вычислите плотность азота по водороду и воздуху.
3. Вычислите объем 0,100 кг газовой смеси состава 3CO + 2CO2 при 500С и давлении 98600 Па.
4. При сжигании 0,310 г некоторого соединения азота с водородом получено 0,348 г воды и 216,7 мл азота при н.у. Плотность пара этого вещества по воздуху 1,10. Какова формула этого соединения?
5. Определите состав смеси железа и магния, если при обработке 0,8 г этой смеси концентрированной хлороводородной кислотой выделилось 4,48 л водорода при н.у.
Вариант 8
1. Средняя плотность по водороду газовой смеси, состоящей из водорода и кислорода, равна 12,5. Вычислите объемные доли, в %, водорода и кислорода в смеси.
2. Вычислите атомную массу двухвалентного металла, если 26,78 г его, реагируя с кислородом, дают 33,333 г оксида. Определите металл. Какое значение имеют эквивалентные массы металла и его оксида?
3. При соединении 1 г фосфора с кислородом было получено 2,29 г оксида фосфора. Выведите формулу оксида фосфора.
4. При полном сгорании навески органического бромсодержащего вещества массой 1,88 г получено 0,88 г окисида углерода (IV) и 0,30 г воды. После превращения всего брома, содержащегося в навеске, в бромид серебра получено 3,76 г AgBr. Плотность паров вещества по водороду равна 94. Определить молекулярную формулу исследуемого вещества.
5. Температура азота, находящегося в стальном баллоне под давлением 12,5 МПа, равна 290 К. Предельное давление для баллона 20,3 МПа. При какой температуре давление азота достигнет предельного значения?
Вариант 9
1. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода при н.у. Вычислите молярные массы эквивалентов оксида и металла.
2. Бертолетова соль при нагревании разлагается с образованием хлористого калия и кислорода. Сколько литров и молей кислорода можно получить из 2-х молей 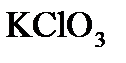 3 при н.у.?
3 при н.у.?
3. Массовые доли натрия, кремния и кислорода в соединении соответственно равны, в %,: 37,71, 22,95, 39,34. Определите простейшую формулу этого соединения.
4. Какой объем водорода при н.у. надо затратить для восстановления 125 г 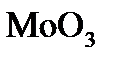 до металла?
до металла?
5. К раствору, содержащему 0,20 моль FeCI3 , прибавили 0,24 моль гидроксида натрия. Сколько молей 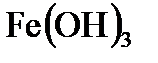 образовалось при этом и сколько молей и какого вещества осталось в избытке?
образовалось при этом и сколько молей и какого вещества осталось в избытке?
Вариант 10
1. Определите металл и молярную массу его эквивалента, если 0,00336 кг трехвалентного металла вытесняют из раствора щелочи 4,244 л водорода при 0  С и 99,8 кПа.
С и 99,8 кПа.
2. Вычислите массу газообразного SO2, занимающего объем 450 мл при 800С и 98 642 Па.
3. Рассчитайте массу образующейся воды в реакции SO2 + 2H2 = S + 2 H2 О, если в реакцию вступило 0,6 моль SO2.
4. Бертолетова соль при нагревании разлагается с образованием хлорида калия и кислорода. Какую массу кислорода можно получить, если разлагается 13,25 г соли?
5. При соединении 1 г фосфора с кислородом было получено 2,29 г оксида фосфора. Выведите формулу оксида фосфора.
Вариант 11
1. Вычислите объем 1,00 кг газовой смеси состава 2CO + 3CO2 при 500 С и давлении 98600 Па.
2. Рассчитайте массу и объем оксида азота (II), если прореагировало 2 моль кислорода (при н.у.) в процессе: 4 NH 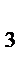 + 5O
+ 5O 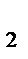 = 4 NO + 6 H
= 4 NO + 6 H 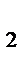 O.
O.
3. Какой объем водорода при н.у. надо затратить для восстановления 1,25 г 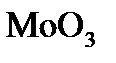 до металла?
до металла?
4. После взрыва 0,020 л смеси водорода с кислородом осталось 0,0032 л кислорода. Найдите первоначальный состав смеси в процентах по объему.
5. Масса 1л воздуха при 101,33 кПа и 20 градусах по Цельсию равна 1,2г. Вычислите среднюю мольную массу воздуха.
Вариант 12
1. Порошок частично окисленного магния массой 5,10 г обработали соляной кислотой. При этом выделилось3,74 л Н2, измеренного при нормальных условиях. Сколько процентов магния содержалось в образце?
2. Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода (объем измерен при нормальных условиях). Определите массу металла.
3. При сжигании 3,00 г антрацита получилось 5,30 л СО2, объем газа измерен при нормальных условиях. Сколько процентов углерода содержит антрацит?
4. Температура азота, находящегося в стальном баллоне под давлением 10,5 МПа, равна 250 К. Предельное давление для баллона 20,3 МПа. При какой температуре давление азота достигнет предельного значения?
5. Найдите простейшую формулу оксида ванадия, зная, что 2,73 г оксида содержат 1,53 г металла.
Раздел 2
Дата: 2018-11-18, просмотров: 816.
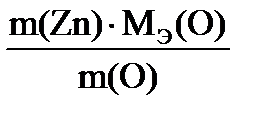 =
= 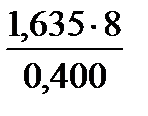 = 32,700 г/моль.
= 32,700 г/моль.