Мета роботи:ознайомитисязфотоколориметричним методом хімічного аналізу,набути навичок визначення амічного азоту, нітратів і фосфатів у воді.
Знати:колообіг біогенних елементів у водоймах, суть методу визначення аміачного азоту, нітратного азоту, фосфатів у воді.
Вміти:будувати градуювальні графіки для фотоколориметричногоаналізу, визначати аміак, нітрати і фосфати в різних пробах води (питна, річкова, озерна, стічна), порівнювати отримані дані з ГДК, давати оцінку придатності води для водокористування.
Теоретична частина
Нітроген є основним компонентом живих організмів. У природі, зокрема й у водоймах, постійно відбувається колообіг сполук нітрогену за участю численних процесів, як у живій природі, так і в неживій. Внаслідок розкладання білків у водоймах утворюється аміак, який із часом окиснюється до нітритів і нітратів.
Найбільшими забруднювачами природних вод аміаком є тваринницькі ферми, нітратами - поверхневі води з полів та стічні води хімічних виробництв. Вони спричинюють бурхливий розвиток синьозелених водоростей і порушення функціонування водних екосистем.
Наявність тих чи інших сполук нітрогену дає змогу встановити час надходження забруднених аміачними сполуками стічних вод (рис. 3):
§ наявність аміаку і відсутність нітритів і нітратів - забруднення відбулося недавно;
§ одночасна наявність і відновлених, і окиснених сполук нітрогену - з часу скидання стічних вод пройшов певний час;
§ високий вміст нітритів і особливо нітратів за відсутності сполук амонію - забруднення давнє - аміак встиг окиснитися:
2NH3 + 3О2 = 2HNO2 + 2Н2О;
2HNO2 + О2 = 2HNO3.
Вміст нітратів у питній воді не має перевищувати 45 мг/л; нітритів - 3,3 мг/л.
 
|
Рис. 3.Форми сполук нітрогену у стічних водах в анаеробних умовах:
|
Визначення аміаку
Метод базується на утворенні комплексної сполуки йодиду оксимеркуратамонію червоно-коричневого кольору під час взаємодії йона амонію чи аміаку з реактивом Несслера:
NH3 + 2K2[HgI4] + 3КОН = [O  NH2] + 7КІ + 2Н2О
NH2] + 7КІ + 2Н2О
Чутливість методу визначення аміаку дорівнює 0,05 мг/л, що значно нижче від ГДК. Без розбавляння можна визначити не більш як 4 мг/л NH4+ в 1 л води.
Твердість усувають додаванням сегнетової солі або комплексону ІІІ; ферум, сульфіди та каламутність води - за допомогою солі цинку (до 100 мл проби додають 1 мл розчину сульфату цинку (100 г ZnSО4·7Н2О в 1 л бідистильованої води), суміш перемішують і 25%-м розчином гідроксиду натрію чи калію доводять рН до 10,5 (контроль рН-метром); після утворення осаду його відділяють фільтруванням крізь скляний фільтр або центрифугуванням; при цьому збільшується об'єм розчину, який необхідно врахувати під час розрахунків).
Хід роботи
1. У мірну колбу місткістю 50 мл вносять об'єм досліджуваного розчину, який містить 5-40 мкг амонійного нітрогену.
2. Приливають 0,5 мл сегнетової солі і додають 1 мл реактиву Несслера, доводять об'єм дистильованою водою до риски і перемішують.
3. Через 3 хв вимірюють оптичну густину розчину на ФЕК з синім світлофільтром (λ =400 нм) в кюветі з товщиною поглинального шару 10 мм. Масу йонів амонію в пробі визначають за градуювальним графіком.
Побудова градуювальної кривої. У мірні колби місткістю 50 мл вміщують 0,5: 1,0: 2,0; 3,0 і 4,0 мл робочого стандартного розчину, додають по 30-40 мл дистильованої води, по 1 мл реактиву Несслера і потім виконують аналіз так як описано вище.
Масову концентрацію амонійного азоту ρ(NH4+ )обчислюють за формулою:
 , мг/л;
, мг/л;
Молярну концентрацію еквіваленту амонійного азоту С(1/zNH4+) обчислюють за формулою:
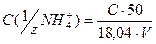 , ммол-екв./л
, ммол-екв./л
де С - маса амонійного нітрогену в пробі, визначена за графіком, мг;
V- об'єм аналізованого розчину використаного дня аналізу, мл;
50 - об'єм мірної колби, мл;
18,04 – еквівалент NH4+ .
Визначення нітратів
У сульфатному середовищі нітрат-іони утворюють з саліцилатом натрію суміш 3- та 5-нітросаліцилових кислот, солі яких у лужному середовищі мають жовте забарвлення. Чутливість фотометричного визначення за цією реакцією становить 0,1 мг/л NO3-.
Хід роботи
1. До 10 мл або іншого об'єму проби води, яка містить не більш як 0,2 мг NO3-, додають 1 мл свіжоприготованого 0,5%-го розчину саліцилату натрію і випарюють досуха у фарфоровій чашці на водяній бані.
2. Після охолодження до сухого залишку додають 1 мл концентрованої сульфатної кислоти і залишають стояти 10 хв. (якщо утворюється забарвлений розчин, цей метод непридатний).
3. Вміст чашки розбавляють дистильованою водою, кількісно переносять у мірну колбу на 50 мл і додають 7 мл розчину NaOH.
4. Після охолодження доводять об'єм розчину дистильованою водою до позначки, перемішують.
5. Вимірюють оптичну густину розчину при довжині хвилі 400 нм у кюветі з такою товщиною шару 10 мм. Розчин порівняння - дистильована вода.
6. Від визначених значень оптичної густини віднімають оптичну густину контрольної проби, приготовленої таким самим способом з дистильованою водою.
7. За градуювальним графіком визначають вміст нітрат-іонів.
Для побудови градуювального графіка готують стандартні розчини, які містять 0; 0,005; 0,01; 0,02; 0,05; 0,10 та 0,20 мг NO3-. Для цього відбирають 0; 0,5; 1,0...20,0 мл стандартного розчину нітрату калію з концентрацією 0,01 мг/л NO3- і доводять дистильованою водою або випарюють приблизно до 10 мл. Далі діють, як зазначено вище, і будують градуювальний графік у координатах ''оптична густина - кількість NO3-, мг."
Масову концентрацію нітрат-іонів ρ(NO3-) або молярну концентрацію еквіваленту С(1/zNO3-) обчислюють за формулами:
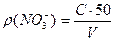 , мг/л;
, мг/л;
 , ммоль-екв./л
, ммоль-екв./л
де С - кількість нітрат-іонів, визначена за градуювальним графіком, мг;
V - об'єм проби води, мл;
50 - об'єм мірної колби, мл;
62,0- молярна маса еквівалента NO3-.
Дата: 2016-10-02, просмотров: 346.