Розрахувати розчинність речовини в моль/л, г/л згідно вашого варіанту, користуючись значеннями добутку розчинності речовин.
| Варіант | Формула речовини | ДР | Розчинність | |
| моль/л | г/л | |||
| AgBr | 5,3•10-13 | |||
| AgCl | 1,8•10-10 | |||
| AgI | 8,3•10-17 | |||
| BaCO3 | 5,1•10-9 | |||
| BaCrO4 | 1,2•10-10 | |||
| BaSO4 | 1,1•10-10 | |||
| CaCO3 | 4,8•10-9 | |||
| CaC2O4 | 20,3•10-9 | |||
| CaF2 | 4,0•10-11 | |||
| CaSO4 | 1,3•10-8 | |||
| CuS | 6,3•10-36 | |||
| HgS | 1,6•10-52 | |||
| FeS | 5•10-18 | |||
| FePO4 | 1,3•10-22 | |||
| PbF2 | 2,7•10-8 | |||
| MnS | 2,5•10-10 | |||
| PbI2 | 1,1•10-9 | |||
| Mg(OH)2 | 6,0•10-10 | |||
| Zn(OH)2 | 7,1•10-18 | |||
| ZnCO3 | 1,45•10-11 |
Лабораторна робота № 5
Тема: Визначення твердості води та йонів Кальцію і Магнію
Мета роботи: набути навичок визначення твердості води, концентрації йонів Магнію і Кальцію.
Знати:кругообіг кальцію в природі, поняття “тимчасова” і “загальна” твердість, способи усунення твердості води.
Вміти: експериментально визначати твердість води, вміст йонів Кальцію і Магнію у воді, проводити розрахунки за результатами аналізу.
Теоретична частина
Твердість води зумовлена наявністю солей кальцію і магнію. Розрізняють карбонатну і некарбонатну твердість, перша зумовлена гідрокарбонатами, друга - переважно хлоридами і сульфатами кальцію і магнію. Карбонатну твердість ще називають тимчасовою, або усувною, оскільки під час кип'ятіння гідрокарбонати руйнуються і випадають в осад карбонати і гідроксокарбонати:
Са(НСО3)2  СаСО3↓ + Н2O + СО2↑;
СаСО3↓ + Н2O + СО2↑;
Mg(HCO3)  MgCO3↓ + H2O + СО2↑;
MgCO3↓ + H2O + СО2↑;
2Mg(HCO3)2  (MgOH)2CO3↓ + Н2O + 3СО2↑,
(MgOH)2CO3↓ + Н2O + 3СО2↑,
хоча цілком позбутися карбонатної твердості неможливо через значну розчинність гідроксокарбонату магнію (MgOH)2CO3. Саме утворення малорозчинних карбонатів (значно меншою мірою сульфатів та інших солей кальцію і магнію) призводить до утворення накипу в чайниках, бойлерах, трубах і котлах парового опалення, теплообмінному обладнанні, що завдає значних економічних збитків внаслідок забивання труб і необхідності їх заміни або промивання розчинами кислот, зниження їх ефективності.
У твердій воді ускладнюються процеси миття й прання, збільшується витрата мила через утворення пластівців нерозчинних солей кальцію і магнію.
У водоймах із м'якою водою (до 20 мг/л СаСО3) дія отруйних неорганічних сполук проявляється при нижчих концентраціях, ніж у водоймах із твердою водою (хлориду кадмію - при 0,6 мг/л і 73,5 мг/л; сульфату купруму - 0,02 і 1,8; сульфату берилію – 0,14 і 20,3 мг/л відповідно).
Некарбонатну (сталу) твердість усувають додаванням карбонату чи фосфату натрію, які осаджують катіони кальцію і магнію у вигляді нерозчинних солей, наприклад:
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4;
3СаСl2 + 2Na3PO4 = Са3(РO4)2↓ + 6NaCl.
У природні води сульфати й хлориди потрапляють під час дренування площ із гірськими породами, що містять гіпс, зі скидами неочищених стічних вод, змивами хлоридів кальцію і натрію, якими взимку посипають тротуари для запобігання утворенню крижаних корок.
Кількісно твердість води виражають у ммоль·екв. йонів Са2+ і Mg2+ в 1 л води. 1 ммоль·екв. твердості відповідає 20,04 мг Са2+, 12,16 мг Mg2+ або 50 мг СаСО3 (табл. 3).
Таблиця 3. Типи природних вод за твердістю
| Тип води | ммоль екв/л | Твердість | ||
| Са2+, мг/л | Mg2+, мг/л | СаС03, мг/л | ||
| Дуже м'яка | 0-1,5 | 0-30,06 | 0-18,24 | 0-75,00 |
| М'яка | 1,5-3,0 | 30,06-60,12 | 18,24-36,48 | 75,00-150,00 |
| Середньо-тверда | 3,0-4,5 | 60,12-90,18 | 36,48-52,72 | 150,00-225,00 |
| Досить тверда | 4,5-6,5 | 90,18-130,26 | 52,72-79,04 | 225,00-325,00 |
| Тверда | 6,5-11,0 | 130,26-220,44 | 79,04-131,76 | 325,00-550,00 |
| Дуже тверда | >11,0 | >220,44 | >131,76 | >550,00 |
Чинними санітарними нормами передбачено, що твердість питної води не має перевищувати 250 мг/л СаСО3, а твердість понад 500 мг/л СаСО3 вважається небезпечною для здоров'я.
Твердість води визначають комплексометричним методом. Пробу води не консервують, твердість визначають упродовж 2 діб з часу відбору проби на аналіз.
Метод грунтується на взаємодії катіонів Кальцію і Магнію з трилоном Б в аміачному буферному розчині (рН~9,5) з утворенням внутрішньокомлексних сполук (за наявності металохромних індикаторів). Чутливість методу 0,001 ммоль·екв/л.
Катіони важких металів перешкоджають визначенню, тому їх попередньо осаджують у вигляді малорозчинних сполук чи зв'язують у стійкі комплекси (маскують).
Досліджувана вода має бути прозорою (каламутну воду заздалегідь фільтрують). Мастило, яке знебарвлює індикатор, також видаляють фільтруванням. Титрування виконують за кімнатної температури. Початкове значення рН аналізованої проби води має становити 4,3, оскільки лише при цьому аміачний буферний розчин забезпечує необхідний рН = 9,5.
Хід роботи
1. Беруть 10-100 мл досліджуваної води і доводять об'єм дистильованою водою до 100 мл, додають 5 мл аміачного буферного розчину і 10-15 мг індикатора хромогену чорного.
2. Пробу повільно титрують трилоном Б, інтенсивно струшуючи, до переходу забарвлення розчину з винно-червоного в ясно-синій.
Розрахунок твердості води проводять за формулою:
Тзаг. = 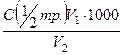 , ммоль·екв/л
, ммоль·екв/л
де V1 - об'єм розчину трилону Б, мл;
V2 - об'єм досліджуваної води, мл;
 - молярна концентрація еквівалентів розчину трилону, моль/л.
- молярна концентрація еквівалентів розчину трилону, моль/л.
За цією методикою визначають твердість води від 0,5 до 20,0 ммоль·екв/л за відсутності у воді катіонів купруму, цинку, мангану.
Оскільки карбонатна твердість води зумовлена йонами НСО3-, її визначають титруванням проби води розчином хлоридної кислоти. Усувну твердість визначають за різницею між вмістом НСО3- до і після кип'ятіння проби води.
Кальцій та Магній
Йони Кальцію і Магнію грають важливу роль в сольовому складі природних вод. Оптимальне співвідношення солей кальцію і магнію у водоймищах зі слабо мінералізованою водою становить Ca2+ : Mg2+ як 3:1. У сильно мінералізованій воді це співвідношення звичайно становить 3:2, тобто більше міститься солей магнію.
Концентрація йонів Кальцію в природних водах залежить від стану хімічної рівноваги карбонатної системи. Кальцій та Магній визначають комплексометричним титруванням, яке ґрунтується на таких же реакціях, як і визначення твердості води.
Титрування Кальцію розчином трилона-Б проводять у присутності мурексиду як металохромного індикатора. Концентрацію Магнію розраховують як різницю між твердістю води і вмістом Кальцію.
Хід роботи
1.В конічну колбу на 250 мл відбирають піпеткою 50-100 мл природної води, що досліджується.
2. Додають 2-5 мл розчину NаОН з молярною концентрацією еквівалента С(NаОН)= 2 моль/л.
3. Додають на кінчику скальпеля (10-15 мг) індикатора мурексиду.
4. Титрують пробу води трилоном- Б до переходу забарвлення з рожевого у фіолетове.
5. Обчислюють масову концентрацію йонів кальцію r(Сa2+) в мг/л за формулою:
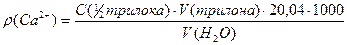 ,
,
де C(½трилона) - молярна концентрація еквіваленту трилона Б, моль/л;
V(трилона) - об'єм трилона- Б, що витрачено на титрування проби води, мл;
V(H2O) - об'єм проби води, взятої для аналізу, мл;
20,04 - молярна маса еквівалента йона кальцію, г/моль.
r (Сa2+) - масова концентрація йонів кальцію, мг/л;
Відповідно молярна концентрація еквіваленту йонів Кальцію в ммоль/л розраховується за формулою:
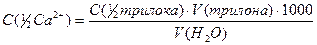 , або
, або
 ,
,
де C (½Сa2+) - молярна концентрація еквіваленту йонів кальцію, ммоль/л.
Концентрацію Магнію обчислюють за формулами:
r (Mg2+) =12,16•[T – C(½Ca2+)]
С(½Мg) =T - C (½Сa2+)
Контрольні питання для самопідготовки
1. Які сполуки зумовлюють твердість природної води?
2. Які солі зумовлюють карбонатну твердість води?
3. Які солі зумовлюють загальну твердість природної води?
4. Які типи твердості води Вам відомі?
5. На чому грунтується комплексометричний метод визначення загальної твердості води?
6. Які методи усунення твердості води Вам відомі?
7. Джерела йонів Са2+ у природних водах.
9. Біологічне значення йонів Са2+ і Мg2+.
10. Постійна твердість води зумовлена присутністю у воді солей:
а) гідрокарбонатів кальцію і магнію;
б) хлоридів кальцію і магнію;
в) нітратів кальцію і магнію;
г) сульфатів кальцію і магнію.
11. Оптимальні показники твердості у прісних водоймах:
а) 6 - 10; б) 3 - 5; в) 4 - 6; г) 10 - 12.
12. Твердість води вимірюється:
а) мг/л; б) %; в) ммоль-екв/л; г) моль/л.
Дата: 2016-10-02, просмотров: 433.