Мета роботи: набути навичок визначення вмісту розчиненого кисню у воді.
Знати: методику відбору проб води для визначення розчиненого кисню.
Вміти: проводити відбір проб у кисневу склянку, титрувати розчин, проводити розрахунки, порівнювати отримані дані з ГДК.
Теоретична частина
Розчинений у воді кисень є одним з головних гідрохімічних показників екологічного стану водойми, що обумовлюють процеси самоочищення. Зниження концентрації кисню супроводжується активацією процесів денітрифікації сірководневого бродіння, збільшенням розчинності органічних речовин донних відкладів, підвищенням рухомості заліза, марганцю, кремнію та інших елементів. Усе це погіршує органолептичні показники якості води і екологічний стан водойм. У природні водойми кисень надходить з атмосферним повітрям і виділяється в процесі фотосинтезу водними рослинами, водоростями та фітопланктоном.
При забрудненні водойм пестицидами і промисловими стічними водами, які містять сполуки, що легко окислюються, спостерігається різке зниження розчиненого кисню і при цьому ускладнюється визначення дійсного вмісту кисню. Крім того, пестициди отруюють фотосинтезуючі організми, чим значно скорочують природні живі джерела насичення водойми киснем.
Якщо у водойму надходять стічні води, особливо промислові стоки, то оцінювати екологічний чи санітарний стан водойми тільки за вмістом розчиненого у воді кисню абсолютно недостатньо, його завжди треба поєднувати з гідробіологічним аналізом водойми.
Проби води для визначення розчиненого кисню не консервують. Концентрацію розчиненого кисню у воді визначають за методом Вінклера. Суть методу полягає в тому, що при введенні в досліджувану воду лужного розчину солі марганцю утворюється білий осад Мn(ОН)2, який взаємодіє з розчиненим киснем, переходячи в марганцюватисту кислоту (бурий осад):
МnСІ2 + 2КОН = Мn(ОН)2↓ + 2КСІ
2Мn(ОН)2↓ + О2 = 2Н2МnO3↓.
У лабораторії осад розчиняють у кислоті в присутності йодиду калію: йод, що утворився внаслідок реакції, титрують стандартним розчином тіосульфату натрію за наявності індикатора крохмалю:
Н2МnO3↓ + 4НСІ = MnСІ2 +СІ2 + ЗН2О
СІ2 + 2KI = I2 + 2KСІ
І2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Цим методом можна визначити ≥ 0,05 мг O2/л.
Визначенню кисню перешкоджають зависі, які видаляють адсорбцією на А1(ОН)3; окисники, що реагують з КІ (хлор, нітрити, ферум (III) тощо); відновники, котрі взаємодіють з виділеним йодом (сульфіти, тіосульфати, деякі органічні сполуки). Азид натрію усуває вплив нітритів; ферум (III) зв'язують у флуоридний комплекс.
Хід роботи
1. Пробу води відбирають батометром у градуйовану склянку місткістю 250-300 мл доверху, вводять, опускаючи піпетку до дна 2 мл розчину манган (ІІ) хлориду МnCl2 , потім 2 мл лужного розчину калій йодиду (КОН+КІ) на незначну глибину, закривають пробкою, щоб не було бульбашок повітря, і повертають кілька разів колбу для перемішування розчину.
Малорозчинний Н2МnО3 осаджується. За кольором осаду, що утворився, можна орієнтовно судити про концентрацію розчиненого у воді кисню. Якщо його багато, осад швидко побуріє, легке побуріння вкаже на нестачу кисню, при його повній відсутністі осадок залишається абсолютно білим.
2. Через 10-15 хв. Вміст склянки обережно переносять в конічну колбу на 250 мл і додають 5 мл розчину HСІ з масовою часткою 10% та 2 мл розчину КІ з масовою часткою 15% і перемішують.
3. Через 5 хв. відтитровують йод, що виділився, тіосульфатом натрію до солом'яно-жовтого кольору, додають 1 мл крохмалю і титрують до зникнення синього забарвлення.
Масову концентрацію розчиненого кисню С (О2) обчислюють за формулою:
C(О2) = 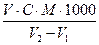 , мг О2/л,
, мг О2/л,
де V - об'єм розчину тіосульфату натрію, витраченого на титрування, мл;
С - молярна концентрація розчину тіосульфату натрію, моль/л;
М - молярна маса еквівалента кисню (8);
V1 - об'єм реагентів (2-4 мл), доданих у кисневу склянку для фіксації кисню, мл;
V2 - місткість кисневої склянки, мл.
Ступінь насиченості води киснем визначають за формулою:
 , %
, %
де ω0 – масова частка розчиненого у воді кисню %;
С(О2) - масову концентрацію розчиненого кисню, мг О2/л;
Со - рівноважна концентрація кисню, мг О2/л (табл. 2), для температури, виміряної під час підбору проби;
Р – атмосферний тиск на момент відбору проби води, кПа;
Таблиця 2. Розчинність кисню у воді за різних значень
Дата: 2016-10-02, просмотров: 306.