| T, °С | С0, мг/л | t, °С | С0, мг/л | t, °С | С0, мг/л |
| 14,7 | 10,5 | 11,35 | 20,5 | 9,31 | |
| 0,5 | 14,5 | 11,23 | 9,23 | ||
| 14,3 | 11,5 | 11,11 | 21,5 | 9,14 | |
| 1,5 | 14,11 | 10,99 | 9,06 | ||
| 13,92 | 12,5 | 10,87 | 22,5 | 8,98 | |
| 2,5 | 13,74 | 10,76 | 8,91 | ||
| 13,56 | 13,5 | 10,65 | 23,5 | 8,83 | |
| 3,5 | 13,39 | 10,54 | 8,76 | ||
| 13,22 | 14,5 | 10,43 | 24,5 | 8,69 | |
| 4,5 | 13,05 | 10,33 | 8,62 | ||
| 12,89 | 15,5 | 10,23 | 25,5 | 8,55 | |
| 5,5 | 12,73 | 10,13 | 8,48 | ||
| 12,58 | 16,5 | 10,03 | 26,5 | 8,41 | |
| 6,5 | 12,43 | 9,93 | 8,35 | ||
| 12,29 | 17,5 | 9,83 | 27,5 | 8,28 | |
| 7,5 | 12,14 | 9,74 | 8,22 | ||
| 18,5 | 9,65 | 28,5 | 8,16 | ||
| 8,5 | 11,86 | 9,56 | 8,1 | ||
| 11,73 | 19,5 | 9,47 | 29,5 | 8,04 | |
| 9,5 | 11,6 | 9,39 | 7,98 | ||
| 11,47 | - | - | - | - |
Контрольні питання для самопідготовки
1. У якому вигляді розчинений кисень знаходиться у природній воді?
2. Яка методика відбору проб води для визначення концентрації розчиненого кисню?
3. В чому суть методу визначення концентрації розчиненого кисню у воді?
4. Від чого залежить насиченість водойм киснем?
5. Вплив температури на вміст кисню у воді.
6. Чому концентрація розчиненого кисню у воді є якісним показником самоочищувальної здатності водойм?
7. Як впливає вміст органічних сполук, метеофактори на насиченість водойм розчиненим киснем?
8. Як оцінюють екологічний чи санітарний стан водойми, в яку надходять стічні води?
9. Які Ви можете запропонувати заходи для збільшення концентрації розчиненого кисню у воді?
Багатоваріантні задачі до теми «Газові закони»
Використовуючи рівняння Менделєєва-Клайперона розрахувати недостаючи величини згідно вашого варіанту.
| Варіант | речовина | М(Х), г/моль | Тиск Р, кПа | Об'єм V | t, °С | Маса m |
| ? | 624 мл | 1,56 г | ||||
| ацетон | ? | 500 мл | 0,93 г | |||
| бензол | 83,2 | ? | 1,3 г | |||
| вода | 3,173 | 100 мл | ? | |||
| ? | 101,3 | 1 л | 2,1 | |||
| повітря | 83,2 | 1 м3 | ? | |||
| азот | ? | 70 г | ||||
| водень | 101,3 | 4 л | ? | |||
| водень | ? | 0,357 г | ||||
| кисень | 99,8 | 152 мл | ? | |||
| 101,3 | 2,8 л | ? | 10 г | |||
| азот | 98,9 | ? | 5,25 г | |||
| водень | 121,6 | 2,5 л | ? | |||
| кисень | 101,3 | ? | ||||
| азот | ? | 1 л | 3,2 г | |||
| кисень | 2,5 л | ? | ||||
| повітря | ? | 2,24 л | 2,9 г | |||
| азот | 101,3 | ? | 2,8 г | |||
| кисень | ? | 4,48 | 6,4 г | |||
| повітря | 101,3 | 5,6 л | ? | 5,8 г |
Лабораторна робота № 3
Тема: Визначення лужності та вмісту гідрокарбонат і карбонат йонів
Мета роботи: набути навичок визначення лужності води та вмісту гідрокарбонат і карбонат йонів в воді.
Знати: джерела лужності води, засоби зменшення загальної лужності.
Вміти: експериментально визначати лужність води, вміст гідрокарбонат та карбонат йонів.
Теоретична частина
Лужність- це вміст у воді речовин, що здатні взаємодіяти з сильними кислотами. Умовно їх можна поділити на три групи: сильні основи (гідроксиди лужних і лужноземельних металів), слабкі основи (решта гідроксидів) та аніони слабких кислот (НСO3-, СО32-, H2PO4-, HPO42-, SO32-, аніони гумінових кислот, HS-, S2- тощо).
Визначенню перешкоджають інтенсивне забарвлення води (усувають додаванням активованого вугілля з подальшим фільтруванням проби), вільний хлор, який знебарвлює індикатор (його видаляють, вводячи у воду еквівалентну кількість тіосульфату натрію з С = 0,1 моль/л), високий вміст вуглекислого газу (перешкоджає правильному визначенню переходу забарвлення індикатора при титруванні; його витісняють, пропускаючи крізь воду повітря).
Хід роботи
У конічну колбу наливають 100 мл аналізованої води, додають 5 крапель індикатору метилового оранжевого, отриманий розчин титрують на білому тлі хлоридною чи сульфатною кислотою до слабо-рожевого забарвлення.
Витрата розчину кислоти на титрування свідчить про вміст у воді аніонів слабких кислот (НСО3-, Н2РО42-, HS-) та слабких основ.
Загальний об'єм витраченої кислоти відповідає загальній лужності води. Розрахунки виконують за формулою:
Alk =  , ммоль·екв/л,
, ммоль·екв/л,
де V(HCl)- об'єм розчину кислоти, витрачений на титрування, мл;
V(H2O) - об'єм аналізованої води, мл;
С (HCl) – молярна концентрація еквіваленту кислоти (0,1 моль/л).
Карбонати й гідрокарбонати при їх спільній присутності
Присутні одночасно у воді карбонати і гідрокарбонати визначають послідовним титруванням проби води хлоридною кислотою, хімізм реакцій:
СаСО3 + 2 HCI « Са(НСО3)2 + СаСI2
Са(НСO3)2 + 2 HCI « H2CO3 + CaCI2
Спочатку протікає тільки перша з вказаних реакцій. Як тільки усі йони СO32- перетворяться в іони НСO3-, рН води дорівнює 8,37. У цей момент у воді практично містяться тільки йони НСO3-, та відсутні йони вільної карбонатної кислоти СО3-2, при подальшому титруванні НСl здійснюється друга реакція і при рН =4,46 у воді йони НСО3- відсутні.
Хід роботи
Аналіз виконують на протязі однієї доби після відбору проби без фіксації води.
1. В колбу для титрування відбирають піпеткою 100 мл природної води, що досліджуються.
2. Додають 5 краплин розчину індикатора - фенолфталеїну з масовою часткою 1%. Якщо колір розчину не змінюється, йони СО32- зовсім відсутні, Vф(НСl)=0,ρ(HCl)=0 мг/л.
3. Обережно титрують розчином хлоридної кислоти з молярною концентрацією 0,1 моль/л до знебарвлення розчину.
4. Визначають об'єм витраченої кислоти VФ(HСl).
5. Додають індикатор метилоранж (2-3 краплі) і продовжують титрування до переходу забарвлення з жовтого кольору в слабко-рожевий.
6. Визначають об’єм витраченої кислоти VМ(HCl).
7. Розраховують масові концентрації карбонатρ( СО32- ), і гідрокарбонат-йонів ρ(НСО3-) в мг/л за формулами:
 ,
,
де r (СO32-) - масова концентрація карбонат йонів, мг/л;
C(HCl) - молярна концентрація хлоридної кислоти, моль/л;
VФ(HСl) - об'єм хлоридної кислоти, що витрачено на титрування з фенолфталеїном, мл;
30 - молярна маса еквівалента М(½ СO32-), г/моль;
V(H2O) - об'єм проби води, взятої для аналізу, мл;
 ,
,
де r (НСO3-) - масова концентрація гідрокарбонат-йона, мг/л;
VM(HСl) - об'єм хлоридної кислоти, яка витрачена на титрування з метилоранжем, мл;
61 - молярна маса еквівалента М(НСO3-), г/моль.
VФ(HСl) - об'єм хлоридної кислоти, що витрачений на титрування з фенолфталеїном, мл;
C(HCl) - молярна концентрація хлоридної кислоти, моль/л;
V(H2O) - об'єм проби води, взятої для аналізу, мл.
Відповідно молярні концентрації еквівалентів карбонат і гідрокарбонат-йонів в ммоль/л розраховуються за формулами:
 , або
, або
 ,
,
де C(½СO32-) - молярна концентрація еквіваленту карбонат-йона, ммоль/л;
 , або
, або
 ,
,
де C(НСO3-) - молярна концентрація еквіваленту карбонат-йона, ммоль/л.
Контрольні питання до самопідготовки
1. Вмістом яких речовин зумовлена лужність води?
2. У який термін після відбору проби води потрібно проводити визначення лужності води?
3. Охарактеризувати загальну та вільну лужність води.
4. Які індикатори слід використовувати для титрування йонів [ОН-]?
5. Які йони утворюють карбонатну систему хімічної рівноваги?
6. Характеристика карбонатної рівноваги СО2, НСО3-, СО32- в залежності від рН.
7. Джерела надходження в природні води НСО3-.
8. В чому полягає методика визначення вмісту [НСО3-] і [СО32-] у природних водах?
9. Карбонатна система відіграє важливу роль в природних водах тому що:
а) сприяє фотосинтезу;
б) володіє буферними властивостями;
в) знижує вміст забруднювачів у воді;
г) запобігає різким змінам рН водного середовища.
Лабораторна робота №4
Тема: Визначення хлоридів (метод Мора)
Мета:набути навичок визначення хлорид-йонів аргентометричним методом.
Знати:методику визначення хлоридів аргентометричним методом.
Вміти:проводити якісне визначення хлорид-йонів, титрувати розчин, порівнювати отримані дані з ГДК.
Теоретична частина
Хлорид-йони зумовлюють солоність морської та океанічної води, а також солоних озер; у прісних водоймах хлориди за концентрацією посідають третє місце після гідрокарбонат- і сульфат-іонів. Вміст йонів Сl-в питній воді регламентується і не має перевищувати 350 мг/л. Мінеральні води часто збагачені хлоридами, зокрема, концентрація їх у цілющій Миргородській досягає 1000-2500 мг/л.
Вміст хлоридів у водах - важлива екологічна характеристика, оскільки різні види гідробіонтів пристосовані до життя у воді з певною солоністю. Більшість рослин (крім галофітів - рослин переважно прибережних зон морів і океанів) зазнає стресу і гине в разі підвищення солоності ґрунтових вод.
Аргентометричний метод Мора базується на осадженні хлорид-йонів розчином аргентум нітрату AgNO3 за наявності калій хромату К2CrО4 як індикатора. Під час титрування AgNO3 спочатку утворюється осад AgCl білого кольору. Коли всі хлорид-іони будуть осаджені, при подальшому додаванні утворюється цегляно-червоний осад аргентум хромату Ag2CrO4:
NaCl + AgNO3 = NaNO3 + AgCl↓;
K2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4↓.
Якщо вміст хлорид-іонів не перевищує 100 мг/л, для титрування використовують розчин аргентум нітрату з концентрацією 0,01 моль/л. Чутливість методу - 2 мг/л Cl-.
Визначенню хлоридів перешкоджають: колір і каламутність води, ціаніди, сульфіти, тіосульфати, катіони феруму, а також фосфати в концентраціях понад 25 мг/л, оскільки вони осаджуються у вигляді аргентум фосфату. Одночасно з хлоридами визначаються і броміди та йодиди, однак їх вміст у воді дуже незначний.
Підготовна проби до аналізу.Якщо в аналізованій воді немає домішок, що перешкоджають визначенню хлоридів, воду фільтрують крізь беззольний фільтр "біла стрічка".
Хід роботи
1. Підготовлена проба води повинна мати рН середовища 8-10. Якщо рН >10, воду нейтралізують (за фенолфталеїном) розчином H2SО4, C( 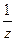 H2SО4) = 0,1 моль/л, якщо рН < 6. Кількість хлоридів у взятій наважці має становити 20-50 мг.
H2SО4) = 0,1 моль/л, якщо рН < 6. Кількість хлоридів у взятій наважці має становити 20-50 мг.
2. Об'єм взятої наважки в конічній колбі доводять до 100 мл дистильованою водою, додають 1 мл 10%-го К2СrO4, титрують розчином AgNO3, C = 0,1 моль/л.
3. Аналогічно виконують контрольний дослід із 100 мл дистильованої води.
Масову концентрацію хлорид-іонів ρ(CІ-) обчислюють за формулою:
 , мг/л,
, мг/л,
де V1- об'єм витраченого розчину AgNO3, С = 0,1 моль/л, на титрування проби, мл;
V2 - об'єм витраченого розчину AgNO3, С = 0,1 моль/л, на титрування дистильованої води, мл;
С(AgNO3) - молярна концентрація розчину AgNO3, моль/л;
35,45 - еквівалент Сl-;
V(H2O)- об'єм проби, взятий для аналізу, мл.
Молярну концентрацію еквіваленту хлорид-йонів C(1/zСІ-) обчислюють за формулою:
 , ммоль/л,
, ммоль/л,
Контрольні питання для самопідготовки
1. Яка міграційна здатність хлорид-йону?
2. Який вміст хлорид-йону у слабко- і помірно-мінералізованих водах?
3. Які є джерела постачання хлорид-йону в природній воді?
4. У чому суть визначення хлоридів за методом Мора?
5. У складі яких солей присутні хлорид-йони?
6. Оптимальні показники концентрації хлоридів для питної води.
7. Оскільки солоність морської води зумовлена наявністю хлорид-йонів, до яких наслідків може призвести полив сільськогосподарських угідь солоною водою?
8. Чому засолення грунтів у посушливих районах часто зумовлене нераціональним поливом земель?
9. Як впливають хлорид-йони на ріст рослин у містах, де тротуари взимку посипають кухонною сіллю чи хлоридом кальцію для запобігання ожеледиці?
10. При визначенні хлоридів за методом Мора титрування відбувається в присутності:
а) фенолфталеїну; б) калій хромату;
в) крохмалю; г) метилоранжу.
Дата: 2016-10-02, просмотров: 324.