Методичні рекомендації
для проведення лабораторних занять з дисципліни "Гідрохімія"для студентів ІІ курсу факультету рибного господарства та природокористування із спеціальності 6.040106 «Екологія, охорона навколишнього середовища та збалансоване природокористування»
Херсон - 2014
УДК : 547(075)
Затверджено на засіданні кафедри хімії і біології (протокол № від 26.01.2014 р.) та рекомендовано до друку науково-методичною радою факультету рибного господарства та природокористування Херсонського державного аграрного університету (протокол № від 12.01. 2014 р.)
Рецензент:
Л.В. Борткевич- кандидат біологічних наук, доцент кафедри біоресурсів та аквакультури ХДАУ
Охріменко О.В. Гафіатулліна О.Г.
«Методичні рекомендації для проведення лабораторних занять з дисципліни «Гідрохімія» для студнтів ІІ курсу факультету рибного господарства та природокористування із спеціальності 6.040106 «Екологія, охорона навколишнього середовища та збалансоване природокористування». Херсон. РВЦ «Колос», ХДАУ -2014. - 60 с.
© Охріменко О.В.
©Гафіатулліна О.Г.
ВСТУП
Основними завданнями вивчення дисципліни “Гідрохімія“ для сучасного фахівця з екології та охорони довкілля є оволодіння основами загальної гідрохімії, тому що склад природних вод, закономірності формування хімічного складу води залежать від хімічних, фізичних та біологічних процесів, які відбуваються в навколишньому природному середовищі, розвиток у студентів навичок та умінь використовувати досягнення сучасної хімії в вирішенні екологічних проблем забруднення водного басейну.
Ці методичні рекомендації складено згідно діючої програми з дисципліни Гідрохімія для студентів ІІ курсу факультету рибного господарства та природокористування. У результаті вивчення навчальної дисципліни студент повинен вміти використовувати експериментальні та розрахункові методи вивчення стану речовин в природних водах; визначати хімічний склад природних вод та основні показники їх фізико-хімічних властивостей, розраховувати ступінь мінералізації води, оцінювати на основі одержаних результатів якість природної води. Завдання методичних рекомендацій – допомогти студентам засвоїти курс гідрохімії.
Методичні рекомендації містять лабораторні роботи, подані за такою схемою: тема і мета роботи, перелік знань і вмінь, які повинні отримати студенти в процесі підготовки до лабораторної роботи та під час її виконання, теоретичний матеріал, що передує експерименту, хід роботи, розрахунки. Наприкінці кожної роботи пропонуються контрольні запитання, на які студент має відповісти під час опитування викладачем перед проведенням лабораторної роботи.
Методичні рекомендації містять багатоваріантні задачі до тем: Газові закони, Добуток розчинності, Твердість води, Водневий показник. Кожен студент розв’язує задачі згідно свого варіанту і надає викладачеві на перевірку.
Загальні рекомендації до виконання лабораторних робіт
Для успішної роботи в хімічній лабораторії необхідно дотримуватись наступних правил й рекомендацій:
1. Точно виконувати усі розпорядження викладача і методичних рекомендацій.
2. Робоче місце тримати в зразковій чистоті.
3. Обережно користуватись приладами, хімічним посудом та хімічним обладнанням.
4.Чітко дотримуватись правил техніки безпеки у хімічній лабораторії.
Навіть при дуже обережній роботі можливі порізи рук склом, опіки гарячими предметами, кислотами, лугами, попадання їдких реактивів в порожнину рота. Тому кожен студент зобов’язаний знати та дотримуватись правил техніки безпеки, вміло поводитись з нагрівальними приладами, скляним посудом, реактивами та розчинами, бути уважним та обережним під час роботи. Кожен, працюючий в гідрохімічній лабораторії, повинен бути в халаті.
На початку заняття викладач перевіряє теоретичні знання та підготовку студента до виконання хімічного дослідження, якщо підготовка є незадовільною - студент не може бути допущений до виконання лабораторного експерименту. Кожне хімічне дослідження слід виконувати самостійно і ретельно. Наприкінці заняття студент повинен навести порядок на робочому місці й скласти протокол роботи, виконати необхідні розрахунки, зробити висновки й подати викладачеві на перевірку.
Лабораторна робота № 1
Тема: Методи відбору проб води. Органолептична оцінка води
Мета роботи:ознайомитись з методами відбору і консервації проб поверхневих вод та основними екологічними характеристиками водойм.
Знати: правила і методи відбору, консервації і зберігання проб води.
Вміти: проводити відбір проб із річок, водосховищ, озер, ставків; складати паспорт проби.
Теоретична частина
До водних об'єктів, які потребують екологічного вивчення, належать океани, моря, річки, озера, штучні водойми, болота, підземні та стічні води.
Вода - менш мінливе, ніж повітря, середовище. Хімічний склад води, її фізичні характеристики, швидкість трансформації забруднювачів залежать від природних чинників:
· хімічного складу грунту берегів і мулу;
· температури;
· багатства рослинного й тваринного світу водойми;
· швидкості течії:
· глибини водойми;
· рН води;
· вмісту розчиненого кисню
та антропогенних, зокрема сусідства
· тваринницьких ферм, звалищ;
· сільськогосподарських угідь, особливо рисових чеків та виноградників, де використовують різноманітні пестициди;
· промислових підприємств, енергетичних об'єктів;
· штучних водосховищ;
· місць скидання господарсько-побутових чи промислових стічних вод.
Стабільність і трансформація хімічних сполук у воді залежать від наявності кількох забруднювальних речовин, які, взаємодіючи між собою, можуть утворювати як нетоксичні, так і більш токсичні, ніж вихідні, сполуки.
Значною мірою впливають на хімічний стан водойм водонаповнення, скидання теплих вод, активізація різних мікробіологічних процесів.
Таблиця 1. Способи підготовки проб води
| Компонент, властивість | Спосіб підготовки | Термін аналізу | Особливості відбору і зберігання |
| РН | Не консервується | 1. Під час відбору проб 2. Упродовж 6 годин | Посудину заповнити повністю, не нагрівати |
| Магній | Не консервується | Упродовж 2 діб | |
| Твердість | Не консервується | Упродовж 2 діб | |
| Кислотність | Не консервується | 1. Під час відбору проб 2. Упродовж 1 доби | Посудину заповнити повністю, не нагрівати |
| Органічні речовини | Не консервується | У день відбору проб | |
| Сульфати | Не консервується | Упродовж 7 діб | |
| Хлориди | Не консервується | Упродовж 7 діб | |
| Лужність | Не консервується | 1. Під час відбору проб 2. Упродовж 1 доби | Посудину заповнити доверху, зберігати при +4°С |
| Ферум | 1. Не консервується 2. 2-4 мл хлороформу на 1 л | Не більше 4 годин Упродовж 1 доби | |
| Кобальт, манган, купрум, нікель, плюмбум | 1. 3 мл нітратної кислоти (р=1,42 г/см3) на 1 л (до рН=2) 2. 5 мл хлоридної кислоти (1:1) на 1 л (до рН=2) | Упродовж 1-2 діб Упродовж 1 місяця | |
| Нафтопродукти | 1. 2-4 мл хлороформу 2. Екстрагують хлороформом на місці відбору проб | Упродовж 1 доби | |
| Окиснюваність перманганатна | 1. Не консервується 2. 5 мл сульфатної кислоти (1:3) на 100 мл води | Не більше 4 годин Упродовж 1 доби | Під час визначення врахувати кількість доданої кислоти |
| Окиснюваність дихроматна | 1. Не консервується 2. 1 мл сульфатної кислоти (р=1,84 г/см') на 1 л води | Не більше 4 годин Упродовж 1 доби |
Результат експерименту залежить від вибраного методу аналізу. Стандартна методика має бути перевірена на конкретній воді, яку аналізують, оскільки зміна компонентів, їх співвідношення чи умов середовища може зумовити необхідність коригування в ході аналізу.
Чутливість методу має відповідати вимогам; висока чутливість потрібна лише в разі дуже малих проб води. Точність визначення хімічного складу вод залежить від його сталості, правильності місця відбору проб, забезпечення умов їх зберігання, методики аналізу, селективності методу.
Визначення температури
Температура є важливим екологічним чинником. Підвищення температури інтенсифікує гідроліз багатозарядних катіонів, спричиняє дегазацію води, збільшує токсичність окремих сполук, прискорює біохімічні процеси у воді водойм. Крім того, кожен живий організм має свій оптимальний режим температур; поза межами стійкості гідробіонти гинуть.
Промислові підприємства, що скидають у природні водойми теплу воду, спричиняють теплове забруднення водойм. Особливо сприяють забрудненню теплові й атомні електростанції - їх води нагріті до 45° С.
Хід роботи
Температуру води визначають за допомогою термометрів (спиртових, ртутних, термісторних тощо). Якщо глибина водойми понад 1 м, температуру визначають через кожний 1 м глибини. При цьому для замірювань на глибині понад 1 м термометр слід «залінивити». Для цього чутливий кінець термометра (спиртову чи ртутну кульку) треба обмазати шаром пластиліну завтовшки в кілька міліметрів. Такий термометр довше сприймає температуру навколишнього середовища (більш «лінивий») і його слід витримувати на глибині замірювання кілька хвилин (тривалість встановлюють дослідним шляхом). Він також довше утримує визначену температуру і не встигає змінити її показ під час підйому його на поверхню. Для замірювань температури на глибинах понад 1 м використовують шпагат із поділками на метри й сантиметри. До нижнього кінця прив'язують термометр і баласт. Попередньо глибину водойми промірюють у місці, де визначатимуть температуру. Глибинні вимірювання температури виконують із містка або човна, причому слід суворо дотримуватися правил безпеки поведінки на воді. Температурні вимірювання проводять одночасно з іншими дослідженнями (відбором проб води, визначенням її прозорості тощо).
Вимірювати температуру води в річці бажано поблизу місця скидання у водойму води з підприємства чи електростанції. У цьому разі замірювання виконують вище й нижче від місця скидання. Складають два температурних профілі річки і порівнюють їх між собою.
Шкала кольоровості
| Кількість, мл розчину 1 | ||||||||||||
| розчину 2 | ||||||||||||
| Градуси кольоровості |
Хід роботи
Готують серію еталонних розчинів: у мірні колби на 100 мл наливають зазначені об'єми розчину 1, доливають до риски розчином 2 і перемішують. Визначають оптичну густину отриманих розчинів і будують градуювальну криву залежності кольоровості від оптичної густини. Потім вимірюють оптичну густину аналізованої води і визначають за графіком кольоровість (якщо вона більше за 80°, воду розбавляють, а результати помножують на кратність розбавляння).
Під час визначення кольору води рекомендують визначати її оптичну густину на спектрофотометрі за різних довжин хвилі або на фотоелектроколориметрі з різними світлофільтрами.
Проби води не консервують, визначення проводять упродовж 2 год, заздалегідь профільтрувавши пробу і відкинувши перші порції фільтрату.
Оптичну густину вимірюють у кюветі з товщиною світлопоглинального шару І см порівняно з дистильованою водою. Довжина хвилі світла, яка найбільше поглинається водою, і є характеристикою її кольору.
Значення оптичної густини досліджуваної води за довжини хвилі, близької до максимуму поглинання, є мірою інтенсивності її забарвлення.
Визначення запаху
За характером запахи поділяють на 2 групи:
• запахи природного походження: землистий, торф'янистий, гнильний, трав'яний, болотний, дерев'янистий, ароматичний, рибний, запах цвілі, сірководневий тощо;
• запахи штучного походження: хлорний, оцтовий, фенольний, бензиновий, камфорний тощо.
Інтенсивність запаху визначають за п'ятибальною шкалою:
0 - запаху немає
1 - дуже слабкий
2 - слабкий
3 - помітний
4 - чіткий (виразний)
5 - дуже сильний.
Визначення характеру й інтенсивності запаху проводять за кімнатної температури і при 60-65° С в колбі, накритій годинниковим склом чи притертою пробкою.
Хід роботи
100 мл аналізованої води при 20º С наливають у колбу місткістю 150-200 мл з широким горлом, закривають, струшують при обертанні, відкривають і визначають характер та інтенсивність запаху.
Порогова концентрація запаху - це концентрація визначуваної речовини в розчині при максимальному розбавлянні, коли запах ще відчутний.
1) Для визначення порогу запаху 200 мл аналізуємої води переносять у конічну колбу місткістю 400-500 мл, додають 200 мл води без запаху (її готують так: пропускають воду крізь колонку з активованим вугіллям; можна додати 0,6 г вугілля на 1 л води, перемішати і профільтрувати крізь шар вати в кімнаті, де немає запахів). Розбавляючи поступово в 2 рази, досягають порогової концентрації, коли запах перестане відчуватися удвох найбільших розбавляннях.
2) У кілька колб, заздалегідь ополіснутих водою для розбавляння, що не має запаху, вносять 200, 100, 65, 50, 40, 33, 25, 20 мл аналізованої води і доводять об'єм водою для розбавляння до 200 мл. Ставлять контроль. Колби закривають.
Починаючи з найбільшого розбавляння, струшують колби і визначають характер та інтенсивність запаху.
Якщо аналізують дуже забруднені води, кількість досліджуваної води може становити 16, 8, 4, 2, 1 мл.
Інтенсивність запаху U аналізованої води обчислюють за формулою:
 ,
,
де V - об'єм проби, взятий для приготування суміші, в якій виявлено відчутний запах, мл.
Зависі і розчинені речовини
Зависі - це часточки мінерального й органічного походження (глина, мул, органічні високомолекулярні сполуки тощо) розміром понад 0,1 мкм., їх вміст характеризує кілька величин.
Визначення прозорості води
Прозорість води залежить від кількості й ступеня дисперсності зависей. Її виражають у сантиметрах водяного стовпа, крізь який видно лінії завтовшки 1 мм, що утворюють хрест (за "хрестом") або шрифт №1 (за Снілленом). Для визначення прозорості води безпосередньо у водоймі застосовують диск Секкі - металевий диск діаметром 20 см, поділений на чотири сектори, два з яких пофарбовані в чорний, а два - в білий колір, з'єднаний із тросиком, що має позначки (рис. 2).
Рис. 2 Диск Секкі
Хід роботи
Вимірювання проводять у затінку чи в похмуру погоду. Диск Секкі опускають у воду, доки він стане невидимим. Записують глибину. Потім диск повільно підіймають, коли його стане видно, записують цю глибину. Середнє з трьох вимірів і буде прозорістю води за диском Секкі. Одночасно ця глибина приблизно означатиме глибину літоралі, тобто прибережної смуги, де можуть рости прикріплені до дна рослини.
Хід роботи
При дослідженні природних вод 100 г глини розтирають із дистильованою водою у фарфоровій ступці, змиваючи розтерту глину в скляну посудину, яку потім заповнюють доверху дистильованою водою і, перемішавши, залишають стояти 60 хв.
Сифоном відбирають із посудини верхній шар води заввишки 180 мм, який містить глинисту суспензію з часточками, що мають гідравлічний розмір менш як 0,05 мм/с. Суспензію води відфільтровують на щільному паперовому фільтрі, висушують при 105° С і розтирають в агатовій ступці. Наважку її в 1 г знову розтирають у ступці з дистильованою водою, змиваючи в мірну колбу місткістю 1 л, в яку налито 200 мл 0,1%-го розчину стабілізатора; об'єм доводять до риски водою (1 мл суспензії містить 1 мг глини).
З отриманої суспензії готують розбавлянням суспензії з концентрацією завислих часточок 1, 2, 5, 10. 20, 40, 60 мг/л, користуючись якими, будують градуювальну криву фотоколориметра, застосовуючи для малих концентрацій (до 10 мг/л) кювету з товщиною світлопоглинального шару 50 мм і тонші кювети для зразків із вищим вмістом суспензії.
Швидко і зручно вимірювати каламутність за допомогою турбідиметра (дослівно "вимірювача каламутності").
Фотометричні методи використовують лише при концентрації зависей менш як 100 мг/л. при більшому вмісті їх визначають гравіметрично, фільтруючи воду крізь беззольні паперові фільтри "синя стрічка" або мембранні фільтри.
Хід роботи
Визначення суми органічних і неорганічних зависей. Беззольні фільтри "біла стрічка" кладуть у бюкси і висушують із відкритими кришками при 105° С упродовж 2 год, охолоджують закриті бюкси з фільтром в ексикаторі і зважують на аналітичних терезах.
Крізь підготовлений таким чином фільтр пропускають 100-1000 мл природної чи стічної води (залежно від вмісту грубодисперсних часточок), осад зі стінок колби змивають невеликою порцією фільтрату в лійку з фільтром.
Після фільтрування фільтр з осадом переносять у той самий бюкс (бюкси і фільтри пронумерувати!), висушують при 105° С, охолоджують в ексикаторі і зважують, закривши кришкою. Висушування, охолодження і зважування повторюють до досягнення сталої маси.
Масову концентрацію грубодисперсних домішок Х обчислюють за формулою:
 , мг/л,
, мг/л,
де а - маса бюкса з осадом на фільтрі, мг; b - маса бюкса з пустим фільтром, мг; V - об'єм води, мл.
Визначення залишку після прожарювання (вміст мінеральних речовин). Зважений після висушування фільтр з осадом обережно переносять пінцетом у заздалегідь прожарений і зважений фарфоровий тигель, ставлять у холодну муфельну піч, доводять температуру до 700° С і прожарюють осад протягом 1 год. Вимикають муфельну піч, обережно виймають щипцями тигель, охолоджують в ексикаторі і зважують.
Масову концентрацію прожарених грубодисперсних часточок Y визначають за формулою:
 , мг/л,
, мг/л,
де с і d - відповідно маса тигля з фільтром до і після прожарювання, мг; V - об'єм аналізованої води, мл.
За різницею (X - Y) визначають вміст органічних зависей, що за температури 700° С згоріли з утворенням переважно оксиду карбону (IV) і води.
Контрольні питання для самопідготовки
1. Як відібрати пробу води з річки або струмка?
2. Яким посудом слід користуватись для відбору проб води?
3. Які консерванти Вам знайомі?
4. Від яких чинників залежить каламутність води?
5. Яким чином тварини-фільтратори змінюють каламутність вод?
6. Чи впливає прозорість води на процеси фотосинтезу у водних рослин і як саме?
7. В яких одиницях визначається каламутність?
8. Як скласти паспорт проби?
Лабораторна робота № 2
Теоретична частина
Розчинений у воді кисень є одним з головних гідрохімічних показників екологічного стану водойми, що обумовлюють процеси самоочищення. Зниження концентрації кисню супроводжується активацією процесів денітрифікації сірководневого бродіння, збільшенням розчинності органічних речовин донних відкладів, підвищенням рухомості заліза, марганцю, кремнію та інших елементів. Усе це погіршує органолептичні показники якості води і екологічний стан водойм. У природні водойми кисень надходить з атмосферним повітрям і виділяється в процесі фотосинтезу водними рослинами, водоростями та фітопланктоном.
При забрудненні водойм пестицидами і промисловими стічними водами, які містять сполуки, що легко окислюються, спостерігається різке зниження розчиненого кисню і при цьому ускладнюється визначення дійсного вмісту кисню. Крім того, пестициди отруюють фотосинтезуючі організми, чим значно скорочують природні живі джерела насичення водойми киснем.
Якщо у водойму надходять стічні води, особливо промислові стоки, то оцінювати екологічний чи санітарний стан водойми тільки за вмістом розчиненого у воді кисню абсолютно недостатньо, його завжди треба поєднувати з гідробіологічним аналізом водойми.
Проби води для визначення розчиненого кисню не консервують. Концентрацію розчиненого кисню у воді визначають за методом Вінклера. Суть методу полягає в тому, що при введенні в досліджувану воду лужного розчину солі марганцю утворюється білий осад Мn(ОН)2, який взаємодіє з розчиненим киснем, переходячи в марганцюватисту кислоту (бурий осад):
МnСІ2 + 2КОН = Мn(ОН)2↓ + 2КСІ
2Мn(ОН)2↓ + О2 = 2Н2МnO3↓.
У лабораторії осад розчиняють у кислоті в присутності йодиду калію: йод, що утворився внаслідок реакції, титрують стандартним розчином тіосульфату натрію за наявності індикатора крохмалю:
Н2МnO3↓ + 4НСІ = MnСІ2 +СІ2 + ЗН2О
СІ2 + 2KI = I2 + 2KСІ
І2 + 2Na2S2O3 = 2NaI + Na2S4O6.
Цим методом можна визначити ≥ 0,05 мг O2/л.
Визначенню кисню перешкоджають зависі, які видаляють адсорбцією на А1(ОН)3; окисники, що реагують з КІ (хлор, нітрити, ферум (III) тощо); відновники, котрі взаємодіють з виділеним йодом (сульфіти, тіосульфати, деякі органічні сполуки). Азид натрію усуває вплив нітритів; ферум (III) зв'язують у флуоридний комплекс.
Хід роботи
1. Пробу води відбирають батометром у градуйовану склянку місткістю 250-300 мл доверху, вводять, опускаючи піпетку до дна 2 мл розчину манган (ІІ) хлориду МnCl2 , потім 2 мл лужного розчину калій йодиду (КОН+КІ) на незначну глибину, закривають пробкою, щоб не було бульбашок повітря, і повертають кілька разів колбу для перемішування розчину.
Малорозчинний Н2МnО3 осаджується. За кольором осаду, що утворився, можна орієнтовно судити про концентрацію розчиненого у воді кисню. Якщо його багато, осад швидко побуріє, легке побуріння вкаже на нестачу кисню, при його повній відсутністі осадок залишається абсолютно білим.
2. Через 10-15 хв. Вміст склянки обережно переносять в конічну колбу на 250 мл і додають 5 мл розчину HСІ з масовою часткою 10% та 2 мл розчину КІ з масовою часткою 15% і перемішують.
3. Через 5 хв. відтитровують йод, що виділився, тіосульфатом натрію до солом'яно-жовтого кольору, додають 1 мл крохмалю і титрують до зникнення синього забарвлення.
Масову концентрацію розчиненого кисню С (О2) обчислюють за формулою:
C(О2) = 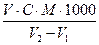 , мг О2/л,
, мг О2/л,
де V - об'єм розчину тіосульфату натрію, витраченого на титрування, мл;
С - молярна концентрація розчину тіосульфату натрію, моль/л;
М - молярна маса еквівалента кисню (8);
V1 - об'єм реагентів (2-4 мл), доданих у кисневу склянку для фіксації кисню, мл;
V2 - місткість кисневої склянки, мл.
Ступінь насиченості води киснем визначають за формулою:
 , %
, %
де ω0 – масова частка розчиненого у воді кисню %;
С(О2) - масову концентрацію розчиненого кисню, мг О2/л;
Со - рівноважна концентрація кисню, мг О2/л (табл. 2), для температури, виміряної під час підбору проби;
Р – атмосферний тиск на момент відбору проби води, кПа;
Таблиця 2. Розчинність кисню у воді за різних значень
Лабораторна робота № 3
Теоретична частина
Лужність- це вміст у воді речовин, що здатні взаємодіяти з сильними кислотами. Умовно їх можна поділити на три групи: сильні основи (гідроксиди лужних і лужноземельних металів), слабкі основи (решта гідроксидів) та аніони слабких кислот (НСO3-, СО32-, H2PO4-, HPO42-, SO32-, аніони гумінових кислот, HS-, S2- тощо).
Визначенню перешкоджають інтенсивне забарвлення води (усувають додаванням активованого вугілля з подальшим фільтруванням проби), вільний хлор, який знебарвлює індикатор (його видаляють, вводячи у воду еквівалентну кількість тіосульфату натрію з С = 0,1 моль/л), високий вміст вуглекислого газу (перешкоджає правильному визначенню переходу забарвлення індикатора при титруванні; його витісняють, пропускаючи крізь воду повітря).
Хід роботи
У конічну колбу наливають 100 мл аналізованої води, додають 5 крапель індикатору метилового оранжевого, отриманий розчин титрують на білому тлі хлоридною чи сульфатною кислотою до слабо-рожевого забарвлення.
Витрата розчину кислоти на титрування свідчить про вміст у воді аніонів слабких кислот (НСО3-, Н2РО42-, HS-) та слабких основ.
Загальний об'єм витраченої кислоти відповідає загальній лужності води. Розрахунки виконують за формулою:
Alk =  , ммоль·екв/л,
, ммоль·екв/л,
де V(HCl)- об'єм розчину кислоти, витрачений на титрування, мл;
V(H2O) - об'єм аналізованої води, мл;
С (HCl) – молярна концентрація еквіваленту кислоти (0,1 моль/л).
Хід роботи
Аналіз виконують на протязі однієї доби після відбору проби без фіксації води.
1. В колбу для титрування відбирають піпеткою 100 мл природної води, що досліджуються.
2. Додають 5 краплин розчину індикатора - фенолфталеїну з масовою часткою 1%. Якщо колір розчину не змінюється, йони СО32- зовсім відсутні, Vф(НСl)=0,ρ(HCl)=0 мг/л.
3. Обережно титрують розчином хлоридної кислоти з молярною концентрацією 0,1 моль/л до знебарвлення розчину.
4. Визначають об'єм витраченої кислоти VФ(HСl).
5. Додають індикатор метилоранж (2-3 краплі) і продовжують титрування до переходу забарвлення з жовтого кольору в слабко-рожевий.
6. Визначають об’єм витраченої кислоти VМ(HCl).
7. Розраховують масові концентрації карбонатρ( СО32- ), і гідрокарбонат-йонів ρ(НСО3-) в мг/л за формулами:
 ,
,
де r (СO32-) - масова концентрація карбонат йонів, мг/л;
C(HCl) - молярна концентрація хлоридної кислоти, моль/л;
VФ(HСl) - об'єм хлоридної кислоти, що витрачено на титрування з фенолфталеїном, мл;
30 - молярна маса еквівалента М(½ СO32-), г/моль;
V(H2O) - об'єм проби води, взятої для аналізу, мл;
 ,
,
де r (НСO3-) - масова концентрація гідрокарбонат-йона, мг/л;
VM(HСl) - об'єм хлоридної кислоти, яка витрачена на титрування з метилоранжем, мл;
61 - молярна маса еквівалента М(НСO3-), г/моль.
VФ(HСl) - об'єм хлоридної кислоти, що витрачений на титрування з фенолфталеїном, мл;
C(HCl) - молярна концентрація хлоридної кислоти, моль/л;
V(H2O) - об'єм проби води, взятої для аналізу, мл.
Відповідно молярні концентрації еквівалентів карбонат і гідрокарбонат-йонів в ммоль/л розраховуються за формулами:
 , або
, або
 ,
,
де C(½СO32-) - молярна концентрація еквіваленту карбонат-йона, ммоль/л;
 , або
, або
 ,
,
де C(НСO3-) - молярна концентрація еквіваленту карбонат-йона, ммоль/л.
Контрольні питання до самопідготовки
1. Вмістом яких речовин зумовлена лужність води?
2. У який термін після відбору проби води потрібно проводити визначення лужності води?
3. Охарактеризувати загальну та вільну лужність води.
4. Які індикатори слід використовувати для титрування йонів [ОН-]?
5. Які йони утворюють карбонатну систему хімічної рівноваги?
6. Характеристика карбонатної рівноваги СО2, НСО3-, СО32- в залежності від рН.
7. Джерела надходження в природні води НСО3-.
8. В чому полягає методика визначення вмісту [НСО3-] і [СО32-] у природних водах?
9. Карбонатна система відіграє важливу роль в природних водах тому що:
а) сприяє фотосинтезу;
б) володіє буферними властивостями;
в) знижує вміст забруднювачів у воді;
г) запобігає різким змінам рН водного середовища.
Лабораторна робота №4
Тема: Визначення хлоридів (метод Мора)
Мета:набути навичок визначення хлорид-йонів аргентометричним методом.
Знати:методику визначення хлоридів аргентометричним методом.
Вміти:проводити якісне визначення хлорид-йонів, титрувати розчин, порівнювати отримані дані з ГДК.
Теоретична частина
Хлорид-йони зумовлюють солоність морської та океанічної води, а також солоних озер; у прісних водоймах хлориди за концентрацією посідають третє місце після гідрокарбонат- і сульфат-іонів. Вміст йонів Сl-в питній воді регламентується і не має перевищувати 350 мг/л. Мінеральні води часто збагачені хлоридами, зокрема, концентрація їх у цілющій Миргородській досягає 1000-2500 мг/л.
Вміст хлоридів у водах - важлива екологічна характеристика, оскільки різні види гідробіонтів пристосовані до життя у воді з певною солоністю. Більшість рослин (крім галофітів - рослин переважно прибережних зон морів і океанів) зазнає стресу і гине в разі підвищення солоності ґрунтових вод.
Аргентометричний метод Мора базується на осадженні хлорид-йонів розчином аргентум нітрату AgNO3 за наявності калій хромату К2CrО4 як індикатора. Під час титрування AgNO3 спочатку утворюється осад AgCl білого кольору. Коли всі хлорид-іони будуть осаджені, при подальшому додаванні утворюється цегляно-червоний осад аргентум хромату Ag2CrO4:
NaCl + AgNO3 = NaNO3 + AgCl↓;
K2CrO4 + 2AgNO3 = 2KNO3 + Ag2CrO4↓.
Якщо вміст хлорид-іонів не перевищує 100 мг/л, для титрування використовують розчин аргентум нітрату з концентрацією 0,01 моль/л. Чутливість методу - 2 мг/л Cl-.
Визначенню хлоридів перешкоджають: колір і каламутність води, ціаніди, сульфіти, тіосульфати, катіони феруму, а також фосфати в концентраціях понад 25 мг/л, оскільки вони осаджуються у вигляді аргентум фосфату. Одночасно з хлоридами визначаються і броміди та йодиди, однак їх вміст у воді дуже незначний.
Підготовна проби до аналізу.Якщо в аналізованій воді немає домішок, що перешкоджають визначенню хлоридів, воду фільтрують крізь беззольний фільтр "біла стрічка".
Хід роботи
1. Підготовлена проба води повинна мати рН середовища 8-10. Якщо рН >10, воду нейтралізують (за фенолфталеїном) розчином H2SО4, C( 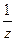 H2SО4) = 0,1 моль/л, якщо рН < 6. Кількість хлоридів у взятій наважці має становити 20-50 мг.
H2SО4) = 0,1 моль/л, якщо рН < 6. Кількість хлоридів у взятій наважці має становити 20-50 мг.
2. Об'єм взятої наважки в конічній колбі доводять до 100 мл дистильованою водою, додають 1 мл 10%-го К2СrO4, титрують розчином AgNO3, C = 0,1 моль/л.
3. Аналогічно виконують контрольний дослід із 100 мл дистильованої води.
Масову концентрацію хлорид-іонів ρ(CІ-) обчислюють за формулою:
 , мг/л,
, мг/л,
де V1- об'єм витраченого розчину AgNO3, С = 0,1 моль/л, на титрування проби, мл;
V2 - об'єм витраченого розчину AgNO3, С = 0,1 моль/л, на титрування дистильованої води, мл;
С(AgNO3) - молярна концентрація розчину AgNO3, моль/л;
35,45 - еквівалент Сl-;
V(H2O)- об'єм проби, взятий для аналізу, мл.
Молярну концентрацію еквіваленту хлорид-йонів C(1/zСІ-) обчислюють за формулою:
 , ммоль/л,
, ммоль/л,
Контрольні питання для самопідготовки
1. Яка міграційна здатність хлорид-йону?
2. Який вміст хлорид-йону у слабко- і помірно-мінералізованих водах?
3. Які є джерела постачання хлорид-йону в природній воді?
4. У чому суть визначення хлоридів за методом Мора?
5. У складі яких солей присутні хлорид-йони?
6. Оптимальні показники концентрації хлоридів для питної води.
7. Оскільки солоність морської води зумовлена наявністю хлорид-йонів, до яких наслідків може призвести полив сільськогосподарських угідь солоною водою?
8. Чому засолення грунтів у посушливих районах часто зумовлене нераціональним поливом земель?
9. Як впливають хлорид-йони на ріст рослин у містах, де тротуари взимку посипають кухонною сіллю чи хлоридом кальцію для запобігання ожеледиці?
10. При визначенні хлоридів за методом Мора титрування відбувається в присутності:
а) фенолфталеїну; б) калій хромату;
в) крохмалю; г) метилоранжу.
Лабораторна робота № 5
Теоретична частина
Твердість води зумовлена наявністю солей кальцію і магнію. Розрізняють карбонатну і некарбонатну твердість, перша зумовлена гідрокарбонатами, друга - переважно хлоридами і сульфатами кальцію і магнію. Карбонатну твердість ще називають тимчасовою, або усувною, оскільки під час кип'ятіння гідрокарбонати руйнуються і випадають в осад карбонати і гідроксокарбонати:
Са(НСО3)2  СаСО3↓ + Н2O + СО2↑;
СаСО3↓ + Н2O + СО2↑;
Mg(HCO3)  MgCO3↓ + H2O + СО2↑;
MgCO3↓ + H2O + СО2↑;
2Mg(HCO3)2  (MgOH)2CO3↓ + Н2O + 3СО2↑,
(MgOH)2CO3↓ + Н2O + 3СО2↑,
хоча цілком позбутися карбонатної твердості неможливо через значну розчинність гідроксокарбонату магнію (MgOH)2CO3. Саме утворення малорозчинних карбонатів (значно меншою мірою сульфатів та інших солей кальцію і магнію) призводить до утворення накипу в чайниках, бойлерах, трубах і котлах парового опалення, теплообмінному обладнанні, що завдає значних економічних збитків внаслідок забивання труб і необхідності їх заміни або промивання розчинами кислот, зниження їх ефективності.
У твердій воді ускладнюються процеси миття й прання, збільшується витрата мила через утворення пластівців нерозчинних солей кальцію і магнію.
У водоймах із м'якою водою (до 20 мг/л СаСО3) дія отруйних неорганічних сполук проявляється при нижчих концентраціях, ніж у водоймах із твердою водою (хлориду кадмію - при 0,6 мг/л і 73,5 мг/л; сульфату купруму - 0,02 і 1,8; сульфату берилію – 0,14 і 20,3 мг/л відповідно).
Некарбонатну (сталу) твердість усувають додаванням карбонату чи фосфату натрію, які осаджують катіони кальцію і магнію у вигляді нерозчинних солей, наприклад:
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4;
3СаСl2 + 2Na3PO4 = Са3(РO4)2↓ + 6NaCl.
У природні води сульфати й хлориди потрапляють під час дренування площ із гірськими породами, що містять гіпс, зі с
Дата: 2016-10-02, просмотров: 306.