1. Определите степени окисления элементов в соединениях, имеющих формулы: SO 3, P 2 O 5 , K 2 Cr 2 O 7, HNO 3, HNO 2, KMnO 4.
2. Методом электронного баланса расставьте коэффициенты в уравнении реакции: 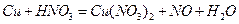
3. Могут ли происходить окислительно-восстановительные реакции между следующими веществами и почему:
а) NH3 и KMnO4
б) HNO2 и HI
в) HCl и H2 Se
4. Методом электронного баланса расставьте коэффициенты в уравнении реакции: КМ nO 4 + KNO 2 + H 2 SO 4 = MnSO 4 + KNO 3 + K 2 SO 4 + Н2О
5. Методом электронного баланса расставьте коэффициенты в уравнении реакции: HNO 3 + Ca = NH 4 NO 3 + Ca ( NO 3 )2 + H 2 O
6. Методом электронного баланса расставьте коэффициенты в уравнении реакции: KClO 3 + FeSO 4 + H 2 SO 4 = KCl + Fe 2 ( SO 4 )3 + H 2 O
7. Методом электронного баланса расставьте коэффициенты в уравнении реакции: Cu + H 2 SO 4 = CuSO 4 + SO 2 + H 2 O
8. Определите степени окисления элементов в соединениях:
а) сернистая кислота
б) нитрат аммония
в) хромат калия
г) азотная кислота
Какие окислительно-восстановительные свойства они проявляют в реакциях?
9. Методом электронного баланса расставьте коэффициенты в уравнении реакции: HCl + CrO 3 = CrCl 3 + Cl 2 + H 2 O
10. Методом электронного баланса расставьте коэффициенты в уравнении реакции: K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 = Cr 2 ( SO 4 )3 + S + K 2 SO 4 + H 2 O
11. Определите степени окисления элементов в соединениях:
а) серная кислота
б) нитрит калия
в) дихромат натрия
г) азотистая кислота
Какие окислительно-восстановительные свойства они проявляют в реакциях?
12. Методом электронного баланса расставьте коэффициенты в уравнении реакции: I 2 + KOH = KIO 3 + KI + H 2 O
13. Методом электронного баланса расставьте коэффициенты в уравнении реакции: KMnO 4 + MnSO 4 + H 2 O = MnO 2 + K 2 SO 4 + H 2 SO 4
14. Методом электронного баланса расставьте коэффициенты в уравнении реакции: SO 2 + Br 2 + H 2 O = HBr + H 2 SO 4
15. Методом электронного баланса расставьте коэффициенты в уравнении реакции: FeCl 3 + H 2 S = FeCl 2 + S + HCl
Электролиз растворов
1. Напишите уравнения электролиза следующих солей: хлорид свинца (II), сульфат калия, нитрат серебра.
2. Электролиз раствора иодида натрия проводили при силе тока 6А в течение 2,5 ч. Составьте электронные уравнения процессов, происходящих на угольных электродах, и вычислите массу вещества, выделившегося на катоде и аноде.
3. Электролиз раствора CuSO 4 проводили в течение 4 часов при силе тока 50А. При этом выделилось 224 г. меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на инертных электродах.
4. Напишите уравнения электролиза следующих солей: сульфит натрия, хлорид меди (II), сульфат цинка.
5. Рассчитайте объем выделившегося на аноде хлора при нормальных условиях из раствора хлорида натрия за 10 ч при токе 30 А и выходе хлора по току 90%. Какой процесс протекает при этом на катоде?
6. Чему равна сила тока при электролизе раствора в течение 1 ч 40 мин 25 с, если на катоде выделилось 1,4 л водорода, измеренного при нормальных условиях?
7. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов хлорида алюминия, сульфата никеля. В обоих случаях анод угольный.
8. При электролизе раствора сульфата меди (II) на аноде выделилось 168 см³ кислорода, измеренного при нормальных условиях. Сколько граммов меди выделилось на катоде? Составьте электронные уравнения процессов, происходящих на электродах.
9. Написать уравнения электродных процессов, протекающих при электролизе водных растворов хлорида бария и нитрата свинца (II) c инертными электродами.
10. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди? Ответ поясните.
11. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6 А через раствор нитрата серебра в течение 30 минут.
12. За 10 мин из раствора платиновой соли при токе силой 5 А выделилось 1,517 г платины. Определить молярную массу эквивалента платины.
13. При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 мин на катоде выделилось 1,071 г металла. Вычислить атомную массу металла.
14. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора и расплава гидроксида калия.
15. Электролиз раствора сульфата некоторого металла проводили при силе тока 6 А в течение 45 мин, в результате чего на катоде выделилось 5,49 г металла. Вычислите молярную массу эквивалента металла. Составьте электронные уравнения процессов, происходящих на электродах.
Гальванический элемент
1. Составьте схемы двух гальванических элементов, в одном из которых никель является катодом, а в другом – анодом. Напишите для каждого из этих элементов электронные уравнения реакций, протекающих на катоде и на аноде. Вычислите ЭДС полученных элементов.
2. Рассчитайте ЭДС гальванического элемента, состоящего из медного и цинкового электродов, погруженных в растворы их сульфатов с концентрацией 0,01 моль/л.
3. Рассчитайте ЭДС гальванического элемента Mg | Mg ( NO 3 )2|| Al ( SO 4 )3| Al, если концентрация ионов магния и алюминия в растворах равны 0,01 моль/л и 0,001 моль/л соответственно.
4. Составить схемы двух гальванических элементов, в одном из которых железо служило бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
5. Определить ЭДС гальванического элемента: А g |А gNO 3 (0,001М)|| А gNO 3 (0,1М)| А g . В каком направлении будут перемещаться электроны во внешней цепи при работе этого элемента?
6. Рассчитать электродные потенциалы Mg в растворе его соли при концентрациях иона 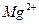 0,1моль/л; 0,01 моль/л и 0,001 моль/л.
0,1моль/л; 0,01 моль/л и 0,001 моль/л.
7. ЭДС элемента, состоящего из медного и свинцового электродов, погруженных в 1 М растворы солей этих металлов, равна 0,47 В. Изменится ли ЭДС, если взять 0,001 М растворы? Ответ обосновать.
8. Магниевую пластинку опустили в раствор его соли, при этом электродный потенциал магния оказался равен – 2,41 В. Вычислите концентрацию ионов магния в моль/л.
9. Увеличится, уменьшится или останется без изменения масса кадмиевой пластинки при взаимодействии ее с растворами: а) нитрата серебра, б) сульфата цинка, в) сульфата никеля. Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
10. Составить схемы двух гальванических элементов, в одном из которых олово служило бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
11. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению:
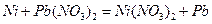
Напишите электронные уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если 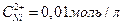 ,
, 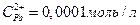 .
.
12. Составьте схему гальванического элемента, состоящего из пластин цинка и железа, погруженных в растворы их солей. Напишите электронные уравнения процессов, протекающих на катоде и на аноде.
13. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из свинцовой и магниевой пластин, опущенных в растворы своих солей с концентрацией 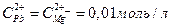 . Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
. Изменится ли ЭДС этого элемента, если концентрацию каждого из ионов увеличить в одинаковое число раз?
14. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, опущенных в растворы своих солей с концентрацией 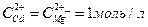 . Изменится ли величина ЭДС этого элемента, если концентрацию каждого из ионов понизить до 0,01 моль/л?
. Изменится ли величина ЭДС этого элемента, если концентрацию каждого из ионов понизить до 0,01 моль/л?
15. Какие химические процессы протекают на электродах при зарядке и разрядке свинцового аккумулятора?
Металлы
1. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: 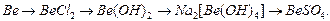
2. Напишите уравнение реакции натрия с водородом, кислородом, азотом и серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
3. Являясь сильными восстановителями, магний, кальций и барий применяются в металлотермии для получения металлов из их оксидов. Составьте электронные и молекулярные уравнения реакций кальция: а) с CaS 04; б) с V 2 O 5 . В каждой из этих реакций окислитель восстанавливается максимально.
4. Осуществите следующие превращения:
Bi → Bi ( NO 3 )3 → NaBiO 3 → Bi 2 ( SO 4 )3 → Bi, имея реактивы: KNO 3 , MnSO 4 , HNO 3 , H 2 SO 4 , Zn , NaOH .
5. Составьте уравнения реакций, которые нужно провести для осуществления следующих превращений: Ca → CaH 2 → Ca ( OH )2 → CaCO 3 → Ca ( HCO 3 )2.
6. Как изменяются химические свойства металлов главной подгруппы II группы элементов с увеличением порядкового номера? В чем заключаются эти изменения и чем они обусловлены?
7. Приведите электронные конфигурации железа и марганца. Укажите возможные степени окисления и приведите примеры соединений. Как ведут себя Fe и М n по отношению к разбавленным растворам кислот H 2 SO 4 и HNO 3?
8. Составьте уравнение взаимодействия К2С r 2 О7 и концентрированной соляной кислоты. Какой объем раствора соляной кислоты (C – 36%, 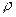 = 1180 кг/м3), необходим для получения 11,2 л Cl2?
= 1180 кг/м3), необходим для получения 11,2 л Cl2?
9. Как влияет повышение степени окисления марганца на свойства его оксидов и гидроксидов? Какие свойства проявляют гидроксид марганца (+4)?
10. Осуществите превращения: Pb → Pb ( NO 3 )2 → Pb ( OH )2 → Na 2 [ Pb ( OH )4] → PbO 2 → PbSO 4 .
11. Осуществите следующие превращения: Sn → SnCl 2 → SnCl 4 → Na 2 [ Sn ( OH )6] → SnCl 4
12. Олово растворяется в концентрированной соляной кислоте, тогда как растворение свинца в соляной кислоте идет с трудом. Чем это можно объяснить? Составьте уравнения реакций растворения свинца в концентрированном растворе NaOH, а олова в концентрированной азотной кислоте. Для последней реакции рассчитайте ЭДС.
13. Приведите электронные конфигурации С r и Мо. Укажите возможные степени окисления элементов и приведите примеры соединений. Какие степени окисления устойчивы для С r и Мо? Как ведут себя С r и Мо по отношению к концентрированным соляной и азотным кислотам? Почему молибден легче всего взаимодействует со смесью кислот HF и HNO 3? Составьте уравнения реакций.
14. Закончите равнения реакций:
Fe + H 2 SO 4 (разб.) →
Fe ( OH )3 + HCl (конц.) →
Fe + HNO 3 (разб.) →
15. Осуществите следующие превращения:
ZnSO 4

Zn → Na 2 [ Zn ( OH )4] → ZnCl 2 → Zn
 |
Zn ( NO 3 )2
Коррозия металлов
1. Каков состав продукта коррозии оцинкованного железа в сернокислой среде при нарушении покрытия? Ответ поясните.
Дата: 2019-11-01, просмотров: 303.