Тема 3. Основы химической термодинамики.
Самостоятельное изучение теоретического материала: Понятия работы и внутренней энергии системы.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Термодинамические расчеты химических реакций».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Элементы химической термодинамики».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Восстановление Fe3O4 оксидом углерода протекает по уравнению:
Fe 3 O 4 (к) + СО (г) = 3 FeO (к) + СО2 (г)
Вычислите ΔGº298 и сделайте вывод о возможности самопроизвольного протекания этого процесса при стандартных условиях. При какой температуре начнется реакция восстановления Fe3O4?
Вопросы для самоконтроля:
1. Как называются функции состояния системы и от чего они зависят?
2. Увеличивается ли внутренняя энергия системы, если Q =0 и W =0?
3. При окислении одного моля 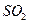 до
до 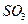 выделяется 98 кДж теплоты. Напишите термохимическое уравнение этой реакции.
выделяется 98 кДж теплоты. Напишите термохимическое уравнение этой реакции.
4. При сгорании ацетилена развивается очень высокая температура, что обусловлено высокой теплотой сгорания ацетилена. На этом основана ацетилено-кислородная сварка черных металлов. Рассчитайте стандартную теплоту и удельную теплоту сгорания ацетилена.
5. Приведите примеры самопроизвольных процессов, сопровождающихся переходом системы из более упорядоченного в менее упорядоченное состояние.
6. Можно ли предсказать влияние температуры на направление химической реакции, если известна ее энтальпия? Ответ подтвердите на примере какой-либо реакции.
7. Возможно ли самопроизвольное окисление азота по уравнению:
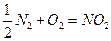
при 298К и других температурах? Ответ подтвердите расчетом.
Тема 4. Кинетика и химическое равновесие.
Самостоятельное изучение теоретического материала: Уравнение Аррениуса. Катализаторы.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Химическое равновесие и кинетика».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Скорость химических реакций и химическое равновесие».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
В газовой фазе протекает обратимая реакция: 2СО + О 2 = 2СО 2 + Q
Напишите уравнение для скорости прямой реакции согласно закону действующих масс и определите, как изменится скорость прямой реакции, если:
а) концентрацию каждого из исходных веществ увеличить в 4 раза;
б) объем исходных веществ увеличить в 3 раза.
Рассчитайте константу равновесия реакции, если равновесные концентрации равны (моль/л): [СО] = 0,2; [О 2 ] = 0,1; [СО 2 ] = 0,3.
Укажите согласно принципу Ле-Шателье, как следует изменить температуру, давление и концентрации веществ, участвующих в реакции, чтобы сместить равновесие в сторону образования продуктов реакции.
Вопросы для самоконтроля:
1. В результате химических реакций за 30 с израсходованы в реакционном пространстве объемом 1 л следующие массы веществ: а) водород – 2 г; б) оксид углерода (II) – 19 г; в) оксид серы (IY) 20 г. Какая из этих реакций протекает быстрее?
2. Определите коэффициент γ для реакции, скорость которой увеличилась в 32 раза при увеличении температуры на 50 К.
3. Воздух содержит азот, кислород, диоксид углерода, водород и другие газы. По какой причине при обычных условиях не происходят самопроизвольно реакции: а) 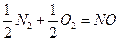 ; б)
; б) 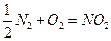 ; в)
; в) 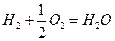 .
.
4. Реакция 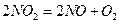 протекает в одну стадию. Напишите кинетическое уравнение реакции. Какова молекулярность этой реакции.
протекает в одну стадию. Напишите кинетическое уравнение реакции. Какова молекулярность этой реакции.
5. Перечислите факторы, влияющие на скорость гомогенных и гетерогенных химических реакций. Дайте характеристику каждого из этих факторов.
Раздел 3. Растворы.
Дата: 2019-11-01, просмотров: 301.