Тема 7. Гальванический элемент.
Самостоятельное изучение теоретического материала: Электрохимический ряд напряжений металлов, активность металлов в зависимости от положения в ряду напряжений металлов.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Электрохимические процессы».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Окислительно-восстановительные реакции».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Методами электронного баланса и ионно-электронного баланса расставьте коэффициенты в уравнении реакции:
K2Cr2O7 + H2S + H2SO4 = Cr2(SO4)3 + S + K2SO4 + H2O
Вопросы для самоконтроля:
1. Приведите примеры соединений, проявляющих только окислительные, только восстановительные и окислительно-восстановительные свойства одновременно.
2. Почему водород находится в ряду напряжений металлов?
3. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом анодом. Написать уравнения реакций, происходящих при работе этих элементов, вычислить значения стандартных ЭДС.
4. Увеличится, уменьшится или останется без изменения масса цинковой пластинки при взаимодействии ее с растворами: а) сульфата магния, б) сульфата меди (II), в) нитрата свинца (II). Почему? Составьте электронные и молекулярные уравнения соответствующих реакций.
5. Использование гальванических элементов. Ответ поясните на конкретных примерах.
Тема 8. Электролиз.
Самостоятельное изучение теоретического материала: Химическая и концентрационная поляризация. Перенапряжение водорода.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Электрохимические процессы».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Написать схему электролиза растворов: сульфата натрия, сульфата алюминия и сульфата меди (II).
Вопросы для самоконтроля:
1. Каковы закономерности электролиза катионов металлов в водных растворах в зависимости от их положения в ряду напряжений?
2. Каковы закономерности электролиза анионов бескислородных и кислородосодержащих кислотных остатков в водных растворах?
3. Какие окислительно-восстановительные процессы протекают при электролизе водных растворов в случае активного анода.
4. Что служит материалом для инертных анодов?
5. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора и расплава гидроксида натрия.
6. Написать уравнения электродных процессов, протекающих при электролизе водных растворов хлорида железа (III) и нитрата кальция c инертным анодом.
7. Применение электролиза. Ответ поясните на конкретных примерах.
Модуль 2. Металлические и неметаллические материалы
Раздел 5. Металлические материалы.
Тема 9. Металлы.
Самостоятельное изучение теоретического материала: Кристаллическое строение металлов.
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Взаимодействие металлов с кислотами».
Вопросы для самоконтроля:
1. Почему при опускании стальных образцов в раствор, содержащий ионы меди, на образцах осаждается медь?
2. Объясните причину нахождения некоторых металлов в природе в свободном состоянии.
3. Если в руде массовая доля халькопирита ( 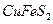 ) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
) составляет 20%, то сколько теоретически можно получить меди и железа из тонны руды?
4. Какие примеси перейдут в раствор, а какие в анодный шлам при электрохимическом рафинировании меди, содержащей марганец, цинк и золото?
5. Напишите реакции восстановления оксида хрома (III) алюминием и хлорида титана (IY) магнием.
Тема 10. Коррозия металлов.
Самостоятельное изучение теоретического материала: Способы защиты металлов от коррозии.
Подготовка к практическому занятию:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению практического занятия «Термодинамика электрохимической коррозии».
Подготовка к лабораторной работе:
- изучить теоретический материал;
- ознакомиться с методическими указаниями по выполнению лабораторной работы «Коррозия металлов».
Выполнение индивидуального задания.
Пример типового индивидуального задания:
Дата: 2019-11-01, просмотров: 319.